Строение коллоидных частиц
Всякий золь состоит из мицелл (частиц дисперсной фазы), и интермицелярной жидкости (дисперсионной среды, в состав которой входят растворитель и растворенные в нем электролиты и неэлектролиты).
Мицеллы имеют сложное строение. Согласно современным представлениям мицелла состоит из электронейтрального агрегата и ионногенной оболочки. Электролит, ионы которого образуют ионогенную оболочку агрегата, называется стабилизатором. При получении золя химическим методом таковым обычно является электролит взятый в избытке. Он сообщает устойчивость коллоидным растворам за счет сил отталкивания одноименно заряженных частиц (гранул).
Масса коллоидной частицы сосредоточена главным образом в агрегате, который состоит из сотен и тысяч атомов и молекул. Например, средняя молярная масса мицеллы гидрозоля гидроксида железа (III) равна 56500 г/моль, а гидрозоля кремниевой кислоты – 49000 г/моль. Следовательно, в первом случае в частицу входит 530 атомов Fe, во втором – 630 атомов Si.
Предположим, что золь иодида серебра образуется в ходе химической реакции:
AgNO3 + KI ® AgI¯ + KNO3.
Основу коллоидных частиц (рис.32) составят микрокристаллы труднорастворимого AgI, включающие в себя m структурных единиц AgI (точнее m пар ионов Ag+ и I–). Эти микрокристаллы называют агрегатом.
 Если реакция протекает в присутствии избытка раствора KI, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции содержащихся в нем в избытке n I––ионов (согласно правилу Панетта – Фаянса, структуру кристаллической решетки могут достраивать только те ионы, которые входят в ее состав или родственные веществу этой решетки). Иодид-ионы в данном случае являются потенциалопределяющими ионами. Агрегат вместе с потенциалопределяющимиионами является частицей твердой фазы, и называется ядром.
Если реакция протекает в присутствии избытка раствора KI, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции содержащихся в нем в избытке n I––ионов (согласно правилу Панетта – Фаянса, структуру кристаллической решетки могут достраивать только те ионы, которые входят в ее состав или родственные веществу этой решетки). Иодид-ионы в данном случае являются потенциалопределяющими ионами. Агрегат вместе с потенциалопределяющимиионами является частицей твердой фазы, и называется ядром.
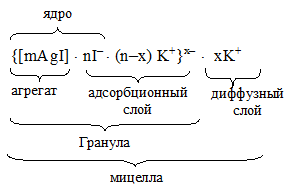
Под действием электростатических сил к ядру притягивается n ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют находящиеся в избытке ионы К+. Часть противоионов (n–x) прочно удерживаются около ядра и образуют вместе с потенциалопределяющими ионами адсорбционный слой. Агрегат и адсорбционный слой вместе составляют гранулу, имеющую заряд вследствие неполной компенсации заряда потенциалопределяющих ионов противоионами, в нашем случае – отрицательный.
Остальные х противоионов К+, слабее связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой среде диффузно (т.е. размыто), поэтому и называются диффузным слоем. Гранула вместе с диффузным слоем противоионов составляет мицеллу. Мицелла электронейтральна. Схему мицеллы можно изобразить следующим образом:
В том случае, если в избытке взят раствор AgNO3, схема мицеллы будет иметь следующий вид:
{[mAgI]×nAg+× (n–x)NO 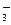 }х+×х NO
}х+×х NO 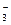
Из приведенных формул видно, что первая мицелла имеет отрицательно заряженную гранулу, вследствие избирательной адсорбции на агрегате ионов I–, а гранула второй мицеллы заряжена положительно за счет ионов Аg+, то есть заряд гранулы определяется зарядом потенциалопределяющих ионов.
При пользовании схемами строения мицелл следует помнить, что мицелла золя не является чем-то постоянным. Числа m, n и х могут изменятся в широких пределах в зависимости от условий получения и очистки золя, а также под воздействием различных внешних факторов. Например, при введении в золь индифферентного (специфически не взаимодействующего с поверхностью) электролита будет происходить сжатие диффузной части (уменьшение радиуса мицеллы). При этом противоионы диффузного слоя начнут переходить в адсорбционный слой, т.е количество противоионов адсорбционного слоя
(n–х) будет возрастат, а количество противоионов диффузногоо слоя (х) – уменьшаться. Заряд гранулы падает и в случае полного перехода ионов в адсорбционный слой частица лишается заряда, (гранула станет нейтральной). Схема мицеллы примет вид:
{[mAgI]×nI–× nK+}0 или {[mAgI]×nAg+× nNO 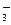 }0
}0
Не имея заряда, коллоидные частицы при сталкивании начнут слипаться, что приведет к укрупнению частиц и выпадению их в осадок под действием силы тяжести. Коллоидная система при этом перейдет в грубодисперсную, а затем произойдет разделение фаз. Таким образом, наличие заряда у частицы дисперсной фазы, как и наличие диффузного слоя, от которого зависит величина заряда частицы, являются основными условиями того, что система не разрушится.
Из этого следует, что для получения устойчивых коллоидных систем обязательно наличие стабилизатора.
Методы получения коллоидных растворов
Коллоидные растворы или золи могут быть получены двумя группами принципиально различных методов: диспергирования и конденсации.
Методами диспергированияназываются методы получения коллоидных растворов, основанные на раздроблении крупных частиц на более мелкие. Различают физические и химические методы диспергирования.
К физическим методам диспергирования относятся механическое дробление с помощью шаровых или коллоидных мельниц, дробление ультразвуком, распылением в электрической дуге.
Химическим методом диспергирования является метод пептизации. Суть его заключается в следующем: к свежеполученному рыхлому осадку добавляют пептизатор (стабилизатор), которым могут быть растворы электролитов, растворы ПАВ или растворители. Например, свежеосажденный осадок Fе(ОН)3 можно обработать раствором FeCI3, содержащим ион-пептизатор Fe3+. Ионы Fe3+, адсорбируясь на кристаллах Fe(OH)3, достраивают кристаллическую решетку и образуют слой потенциалопределяющих ионов. Частицы осадка, приобретая заряд, переходят во взвешенное состояние. Схема мицеллы золя будет иметь вид:
{[mFe(OH)3]× nFe3+× (3n–x)Cl–}х+ × хСl–
Другим способом получения золя методом пептизации является обработка осадка электролитом, частично растворяющим этот осадок. Например, осадок Fe(OH)3 можно обработать небольшим количеством раствора НС1. При этом протекает реакция:
Fe(OH)3+ НС1 ® FeOCl + 2Н2О
Образующаяся в результате реакции соль диссоциирует по схеме:
FeOCl ® FeO+ + Сl– . Ионы этой соли служат пептизатором. Схема мицеллы в данном случае приобретает следующий вид:
{[mFe(OH)3]× nFeO+×(n–x)Cl–}X+× хСl–
При этом способе пептизации важно, чтобы количество добавляемого электролита было очень мало, иначе растворится весь осадок.
Методы конденсации– это методы, связанные с агрегацией молекул в более крупные коллоидные частицы. С их помощью можно получить дисперсные системы из гомогенных растворов. Появление новой фазы происходит при пересыщении среды. Пересыщение (т.е. создание концентраций, превышающих равновесные) можно вызвать с помощью физического процесса или химической реакции.
К физическим методам конденсации относятся:
1. Метод замены растворителя. Основан на медленном добавлении раствора какого-либо вещества к жидкости, которая хорошо смешивается с растворителем, но в которой растворенное вещество настолько мало растворимо, что выделяется в виде высокодисперсной фазы. Например, при вливании спиртовых растворов серы, холестерина или канифоли в воду образуются гидрозоли соответствующих веществ ввиду их малой растворимости в воде.
2. Метод конденсации паров. Основан на пропускании паров какого-либо простого вещества в жидкость. В результате конденсации паров образуются очень устойчивые золи. Пары вещества можно получить электрическим методом. Например, путем распыления металлов под водой или под органической жидкостью в вольтовой дуге или в искровом высокочастотном разряде получают золи металлов. Стабилизаторами для образующихся при конденсации паров металла служат оксиды этих же металлов, являющиеся побочными продуктами процесса распыления. Оксиды адсорбируются на частицах металла и создают защитный слой. В природе при конденсации водяных паров в атмосфере образуются туман и облака.
В основе химических методов конденсации лежат химические реакции, приводящие к образованию нерастворимых в данной среде веществ, в частности, следующие типы реакции.
1. Реакции восстановления. Например, получение золя золота восстановлением золотохлористоводородной кислоты. В качестве восстановителя можно использовать пероксид водорода:
2HAuCl4 + 3H2O2 ® 2Au¯ + 8HCl + 3O2
Золи железа, никеля, вольфрама, свинца и ряда других металлов можно получить электрохимическим восстановлением их солей.
2. Реакции окисления. Такая реакция, в частности, применяется для получения золя серы:
2H2S + O2 ®2S¯ + 2H2O
При этом наряду с серой образуются политионовые кислоты, главным образом пентатионовая кислота H2S5O6, которая стабилизирует золь, адсорбируясь на частицах серы:
{[mS] × nS5O 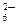 × (2n–x)H+}х–× хH+
× (2n–x)H+}х–× хH+
3. Реакции гидролиза. Этот метод широко применяется для получения золей гидроксидов металлов. Например, золь гидроксида железа получается по реакций:
FeCl3 + 3H2O ® Fe(OH)3¯+ 3HCl
Степень гидролиза возрастает с повышением температуры и с увеличением разведения. Возможны следующие схемы строения мицелл:
{[mFe(OH)3]× nFe3+×(3n–x)Cl–}х+× хСl–
{[mFe(OH)3]× nFeO+×(n–x)Cl–}х+× хСl–
4. Реакции обмена. Позволяют получать золи многих труднорастворимых соединений. Например, при смешивании разбавленных растворов, содержащих неодинаковые количества солей хлорида бария и сульфата натрия, образуется золь сульфата бария:
Na2SO4 + BaCl2 ® BaSO4¯+ 2NaCl
Строение мицеллы золя зависит от того, раствор какого электролита взят в избытке:
{[mBaSO4]×nBa2+× (2n–x)Cl–}х+×хСl– (избыток раствора BaCl2)
{[mBaSO4] × nSO 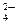 ×(2n–x)Na+}х–× хNa+ (избыток раствора Na2SO4).
×(2n–x)Na+}х–× хNa+ (избыток раствора Na2SO4).
Из всего ранее сказанного следует, что для получения устойчивых коллоидных растворов необходимо выполнить три условия:
1. Дисперсная фаза должна плохо растворяться в дисперсионной среде. Это означает, что при получении коллоидных растворов методом химической конденсации необходимо образование труднорастворимого вещества.
2. Размеры частиц труднорастворимых веществ должны быть в пределах 10–7–10–9 м (1-100 нм). Для этого при использовании химических методов конденсации исходные растворы должны быть достаточно разбавленными.
3. Должен быть стабилизатор (ионы электролитов). Поэтому при получении золей методом химической конденсацией один из электролитов необходимо взять в избытке. При этом раствор электролита, взятого в недостатке, приливают небольшими порциями к раствору электролита, взятого в избытке, до появления легкой мути (или опалесценции).
Методы очистки коллоидных растворов
Дисперсные системы, полученные химическими методами, содержат примеси низкомолекулярных электролитов, снижающих устойчивость коллоидных систем. Их удаляют следующими методами.
Диализ – заключается в очистке золей от примесей низкомолекулярных веществ с помощью чистых растворителей и полупроницаемых мембран. Схема простейшего диализатора показана на рис. 33. Очищаемый золь заливают во внутренний сосуд, дном которого служит мембрана, задерживающая коллоидные частицы или макромолекулы и пропускающая молекулы растворителя и низкомолекулярных примесей. Во внешний сосуд заливают растворитель. Молекулы низкомолекулярных примесей проходят через мембрану во внешнюю среду (диализат), где их концентрация ниже или равна нулю. На рисунке направление потока молекул примесей показано стрелками. При этом частицы дисперсной фазы проникнуть через поры мембраны не могут из-за своих размеров. Очистка идет до тех пор, пока концентрации примесей в золе и диализате не станут близкими. Если обновлять растворитель, то можно практически полностью избавиться от примесей электролитов и низкомолекулярных неэлектролитов.
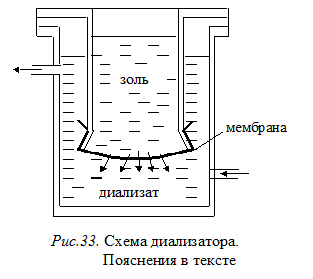 Недостатком метода является большая длительность процесса очистки (недели, месяцы).
Недостатком метода является большая длительность процесса очистки (недели, месяцы).
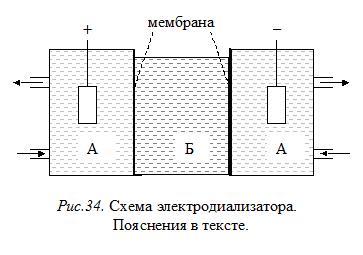 Электродиализ – это диализ, ускоренный за счет применения электрического тока. В данном методе очистку золей от низкомолекулярных электролитов проводят в приборе, называемом электродиализатором (рис. 34). Он представляет собой сосуд, разделенный двумя мембранами на три камеры. В среднюю камеру (Б) наливают коллоидный раствор. В боковые камеры (А) помещают электроды от источника постоянного тока и обеспечивают подвод и отвод растворителя (воды). Под действием электрического тока перенос положительно заряженных частиц из средней камеры в катодную камеру, а отрицательно заряженных частиц – в анодную происходит значительно быстрее. Раствор в средней камере может быть очищен от растворенных солей в течение короткого времени (минуты, часы).
Электродиализ – это диализ, ускоренный за счет применения электрического тока. В данном методе очистку золей от низкомолекулярных электролитов проводят в приборе, называемом электродиализатором (рис. 34). Он представляет собой сосуд, разделенный двумя мембранами на три камеры. В среднюю камеру (Б) наливают коллоидный раствор. В боковые камеры (А) помещают электроды от источника постоянного тока и обеспечивают подвод и отвод растворителя (воды). Под действием электрического тока перенос положительно заряженных частиц из средней камеры в катодную камеру, а отрицательно заряженных частиц – в анодную происходит значительно быстрее. Раствор в средней камере может быть очищен от растворенных солей в течение короткого времени (минуты, часы).
Ультрафильтрация – метод очистки путем продавливания дисперсионной среды вместе с низкомолекулярными примесями через ультрафильтры (мембраны). Очищаемый коллоидный раствор продавливают под давлением через мембрану. При этом молекулы дисперсионной среды и примесей проходят через поры мембраны, а коллоидные частицы остаются на мембране. Промывая коллоидные частицы водой, добиваются быстрой очистки дисперсной фазы от примесей. Очистку можно проводить, не только создавая давления над фильтром, но и создавая разряжение (вакуум) под фильтром путем откачивания воздуха из колбы.
Ультрафильтрацию широко используют для очистки и разделения смеси белков, нуклеиновых кислот, ферментов, а также для стерилизации растворов.
Диализ можно сочетать с ультрафильтрацией. Примером этого является аппарат "искусственная почка", предназначенный для временной замены функции почек при острой почечной недостаточности. Аппарат оперативным путем подключают к системе кровообращения больного; кровь под давлением, создаваемым пульсирующим насосом (“искусственное сердце”), протекает в узком зазоре между двумя мембранами, омываемыми снаружи физиологическим раствором. Благодаря большой рабочей площади мембран (15000 см2) из крови сравнительно быстро (3–4 часа) удаляются шлаки – продукты обмена и распада тканей (мочевина, креатин, ионы калия и др.).
Дата добавления: 2020-07-18; просмотров: 542;










