Молекул бензола и нитробензола
3.2.1. Определить энтальпию разрыва связи C-H в молекуле бензола: С6H6 → C6H5· + H·
Исследование реакции радикального распада молекулы бензола для разрыва связи углерод-водород проводим с использованием ключевого слова "scan" , т.е. расчет зависимости энергии молекулы от длины связи С-Н.
1. Нарисовать молекулу бензола С6H6 в GaussView5.0, используя кнопку  (щелкнуть по кнопке два раза).
(щелкнуть по кнопке два раза).
Выбрать Connectionиз меню Edit. В открывшемся окне справа щелкнуть кнопкуZ-Mat Toolsи выбратьOpt all.Затем нажмитеOK.
Сохраняем File=>Save файл с именем С6H6scan.gjf, при этом убрав галку с квадратика Write Сartesians, появляющегося в нижней строке.
2. Открыть созданный С6H6scan.gjfчерез блокнот. Исправить файл по шаблону
# PM3 opt=z-matrix
пустая строка
Title
пустая строка
0 пробел 1
z-матрица, где в строчке с любым атомом водорода смотрим цифру рядом с длиной связи В
Например В11
B11 значениеВ11 s 20 0.2
После исправления файл сохранить.
3. Открыть программу GAUSSIAN 09. Выбрать File=>Open=>находим С6H6scan.gjf. Проверив все ли разделы находятся в нужном месте, запускаем расчет, нажав на клавишу  в правом верхнем углу. Сохранить С6H6scan.out файл в нужной папке.
в правом верхнем углу. Сохранить С6H6scan.out файл в нужной папке.
4.Открыть в GaussViewфайл С6H6scan.out.Выбрать Results=>Scan.
На графике найти энергетический барьер радикального разрыва связи С-H. Вычислить его значение в кДж/моль (1Нartree=2625.5 кДж/моль).
3.2.2.Используем ключевое слово "scan" для разрыва связи углерод-азот в молекуле нитробензола
С6H5NO2 → C6H5· + NO2·
1. Нарисовать молекулу нитробензола С6H6NO2 в GaussView5.0,
Сначала рисуем молекулу бензола, используя кнопку  , а затем заменяем один водород на нитрогруппу, используя кнопку
, а затем заменяем один водород на нитрогруппу, используя кнопку  (щелкнуть два раза по кнопке) и найти
(щелкнуть два раза по кнопке) и найти 
Выбрать Connectionиз меню Edit. В открывшемся окне справа щелкнуть кнопкуZ-Mat Toolsи выбратьOpt all.Затем нажмитеOK.
Сохраняем File=>Save файл с именем С6H6NO2scan.gjf, при этом убрав галку с квадратика Write Сartesians, появляющегося в нижней строке.
2. Открыть созданный С6H6NO2scan.gjf в папке своей группы через блокнот. Исправить файл по шаблону
# PM3 opt=z-matrix
далее пустая строка
Title
пустая строка
0 пробел 1
z-матрица, где в строчке с атомом азота N смотрим цифру рядом с длиной связи В
Например В11
B11 значениеВ11 s 20 0.2
После исправления файл сохранить.
3. Открыть программу GAUSSIAN 09. Выбрать File=>Open=> и найти файл С6H6NO2scan.gjf. Проверив, все ли разделы находятся в нужном месте, запускаем расчет, нажав на клавишу  в правом верхнем углу. Сохранить С6H6NO2scan.out файл.
в правом верхнем углу. Сохранить С6H6NO2scan.out файл.
4.Открыть в GaussViewфайл С6H6NO2scan.out.Выбрать Results=>Scan.
На графике найти энергетический барьер радикального разрыва связи С-N. Вычислить его значение в кДж/моль (1Нartree=2625.5 кДж/моль).
Исследование нерадикальных реакций мономолекулярного распада нитроалканов в программе Gaussian 09
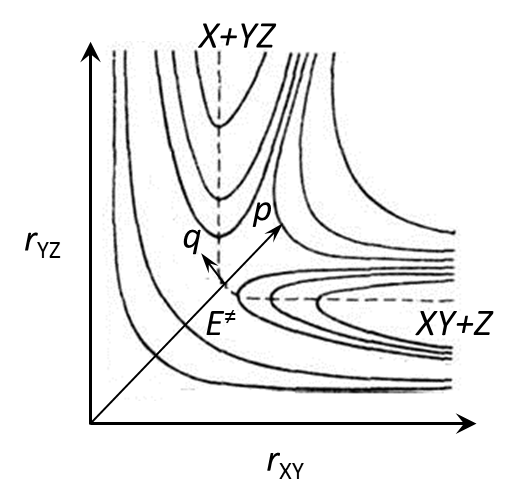
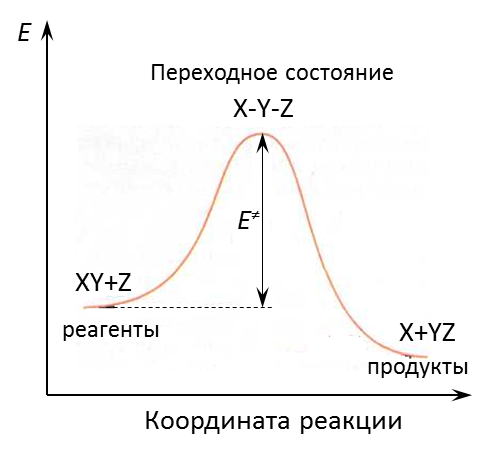
В отличие от двухатомной молекулы, для трехатомной системы XYZ необходимо учитывать уже три геометрических параметра: расстояние между ядрами rXY и rYZ и угол между связями X-Y и Y-Z. Если допустить, что этот угол постоянен и равен 180° в течение всего акта химической реакции XY+Z→X+YZ, то достаточно учесть зависимость энергии E от rXY и rYZ, что дает поверхность, представленная на Рис. 4.1 [14].
 а)
а)
|
 б)
б)
|
| Рисунок 4.1(а) Поверхность потенциальной энергии реакции XY+Z→X+YZ: пунктир – координата реакции q, стрелки – направления q и ортогональной ей координаты p в точке перевала E≠. | Рисунок 4.1(б) Энергетическая кривая вдоль координаты реакции для поверхности, изображенной на рис. 4.1(а). |
Две долины разделенные барьером, соответствуют изолированным реагентам или продуктам, а область вблизи максимума (точки перевала) — переходному состоянию. Переходное состояние, или переходный (активированный) комплекс – это такое состояние молекулярной системы, в котором некоторые связи ослаблены или усилены по сравнению с реагентами. Можно считать, что переходное состояние — это конфигурация атомов, соответствующая переходу от исходных веществ к продуктам в элементарной реакции. А можно выразиться ещё проще: переходное состояние — это уже не реагенты, но ещё не продукты. Разность между максимумом и энергией исходных веществ — это энергия активации прямой реакции (Рис. 4.1б).
В общем случае система из N атомов имеет 3N степеней свободы, из которых 3 поступательные и 3 вращательные относятся ко всей системе как к целому. Всего имеется 3N-6 или 3N-5 (для линейной молекулы) внутренних степеней свободы, и следует строить гиперповерхность потенциальной энергии в пространстве соответствующего числа измерений. И здесь среди всех возможных ядерных конфигураций окажутся такие, которые соответствуют одной или нескольким молекулам (Рис. 4.2).
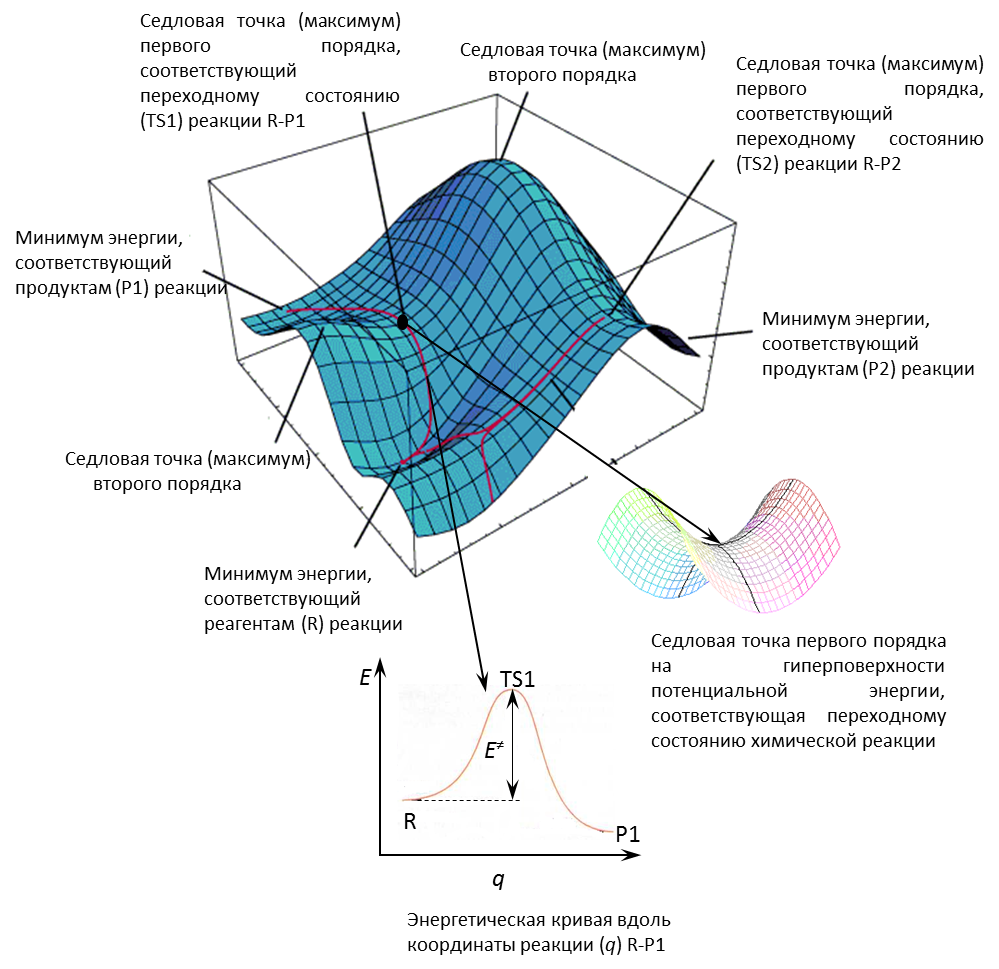
Рисунок 4.2 Модель поверхности потенциальной энергии
Существует множество способов перехода из одного минимума в другой, например, от реагентов R1 к продуктам P1. Любой из них связан с прохождением через области с повышенным значением потенциальной энергии, которые разделяют относительно устойчивые начальное и конечное состояния. На каждом из этих маршрутов существует наивысшая точка – точка перевала. Маршрут, наиболее выгодный в энергетическом отношении, называют маршрутом реакции.
Изучение кинетики и механизмов химической реакции с использованием квантово-химических программ включает несколько основных этапов:
1. Построить и рассчитать реагенты и продукты изучаемой реакции.
2. На основе геометрических структур реагентов и продуктов построить структуру переходного состояния. Провести расчет оптимизации геометрических параметров и частот колебания.
3.Проверить соответствие найденной структуры переходному состоянию.
! Молекулярная структура может быть охарактеризована как переходное состояние по наличию первой мнимой частоты колебания или одного отрицательного значения в матрице Гессе !
4. Проверить соответствие переходного состояния изучаемой реакции проведением расчетов спусков по координате реакции из переходного состояния в сторону реагентов и продуктов реакции.
! Необходимый критерий правильности найденного переходного состояния – первая и последняя точки спусков по координате реакции соответствуют реагентам и продуктам изучаемой реакции !
5.Провести расчет оптимизации и частот колебаний для первой и последней точек спусков по координате реакции.
6. Рассчитать величины энтальпии активации, энтропии активации и энтальпии реакции.
7. Рассчитать константу скорости реакции, определить величину предэкспоненциального множителя, построить графики зависимости lg(k)=f(1/T).
Дата добавления: 2020-07-18; просмотров: 802;











