Основные свойства ковалентной связи – насыщаемость и направленность.
Насыщаемость и максимальная ковалентность.Из рассмотренных выше механизмов образования связи следует, что с точки зрения метода ВС максимально возможное число ковалентных связей (максимальная ковалентность) определяется не только числом валентных электронов, но и общим числом валентных орбиталей. Так, для элементов первого периода максимальная ковалентность равна 1, для второго периода – четырем, так как валентными являются 4 АО – одна 2s- и три 2р-АО. Элементы третьего периода имеют 9 валентных АО – одну 3s, три 3р и пять 3d, и эта максимальная ковалентность практически не реализуется уже по другим причинам (слишком высока энергия возбуждения нескольких электронов на 3d-орбитали; стереохимические, то есть связанные с геометрией молекул, затруднения).
Ограничение числа химических связей атома, вызванное ограниченным числом валентных электронов и орбиталей, называют насыщаемостью ковалентной химической связи. Это свойство, наблюдаемое экспериментально и определяющее стехиометрию молекул (Н2, НСl – существуют, а Н3, Н2Сl - нет), было получено и при квантово-механических расчетах.
Так, Гейтлер и Лондон при расчете системы Н2 + Н не обнаружили волновых функций, связывающих все 3 атома.
Направленность химической связи и углы между связями, гибридизация.Направленность химической связи определяется направленностью в пространстве всех АО с l > 0. Так как лепестки р-орбиталей расположены под углом 1800, а сами px-, py- и pz-АО расположены под углами 900, то следует ожидать, что такие углы будут и в молекулах. Аналогично дело обстоит с d-орбиталями: лепестки образуют угол 900, а между различными d-АО могут быть углы 1800, 900 и 450. Однако на практике множество молекул имеют другие углы между связями: в H2O – 104,50, в NH3 – 1070, в CH4 – 109,280 и т. д.
Для объяснения углов между связями введено представление о гибридизацииатомных орбиталей, то есть о перемешивании орбиталей с различными орбитальными квантовыми числами с получением гибридных (смешанных) АО. Рассмотрим, например, молекулу BeCl2 методом ВС (рис. 4.5).
2s 2p
 
Ве*
3s
Cl Cl Cl ¾ Ве ¾ Cl
Рис. 4.5.Схема ВС и СФ молекулы BeCl2 |
Атом бериллия в возбужденном состоянии имеет два валентных электрона – на 2s- и на 2р-АО. При этом форма молекулы неопределенна, так как одна из связей (2s - 3р) ненаправленна (s-АО шарообразна, имеет одинаковую электронную плотность по всем направлениям). Однако экспериментально доказано, что дипольный момент молекулы равен нулю; так как дипольные моменты каждой из связей больше нуля, то это говорит о том, что молекула линейна, связи Ве-Cl расположены под углом 1800.
Гибридизация 2s- и 2р-АО атома бериллия может быть изображена схемой (рис. 4.6):
Y
Y1
+ -


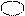











 + + +
+ + +
 | |||||||
 | |||||||
 | |||||||
 | |||||||

 + p
+ p

 s
s
Y2
Исходные 2s- и 2р-АО Ве sp-гибрид-
ные АО
Рис. 4.6.Схема гибридизации s- и р-АО атома Ве
Эта схема соответствует математическому понятию «линейная комбинация атомных орбиталей»:
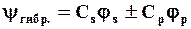
где Сs и Сp – коэффициенты при атомных орбиталях js и jр.
При этом из двух чистых АО (js и jр) образуются две гибридных:
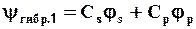 ,
,
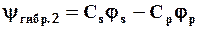 .
.
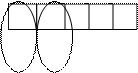
Аналогично этому возможна гибридизация одной s- и двух р-АО - sр2 , одной s- и трех р-АО – sр3. В случае sр2-гибридизации на атоме образуются три гибридных АО, расположенные под углами 1200 и образующие плоский треугольник, а в случае sр3-гибридизации – четыре АО образуют тетраэдр с углами между ними в 109028/ (рис. 4.7).
Перемешивание АО происходит таким образом, что получается наиболее симметричная фигура; соответственно названию этой фигуры называют и типы гибридизации: sp - линейная ( 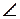 1800), sp2 - треугольная (
1800), sp2 - треугольная ( 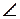 1200), sp3 - тетраэдрическая (
1200), sp3 - тетраэдрическая ( 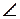 109028'). Имеются и другие типы гибридизации: sp3d2 - октаэдрическая (
109028'). Имеются и другие типы гибридизации: sp3d2 - октаэдрическая ( 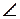 900), sp3d - треугольно-бипирамидальная (
900), sp3d - треугольно-бипирамидальная ( 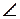 90 и 1200), sp2d - квадратная (
90 и 1200), sp2d - квадратная ( 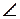 90 и 1800) и другие (табл. 4.2).
90 и 1800) и другие (табл. 4.2).
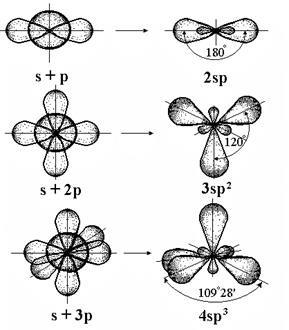
Рис. 4.7. Гибридизация валентных атомных орбиталей
Таблица 4.2
Связь пространственной конфигурации молекул
и ионов с типом гибридизации орбиталей
| Тип гибри- дизации | Пространств. конфигурация молекулы | Тип сое-динений | Примеры |
| sp | линейная | АВ2 | BeF2; HgCl2 |
| sp2 | плоский треугольник | АВ3 | BF3 ; (CО3)2-;SO3 |
| sp3 | тетраэдр | АВ4 | СН4; [Zn(NH3)4]2+ |
| sp2d | квадрат | AB4 | [PdCl4]2- |
| sp3d2 | октаэдр | АВ6 | SF6; [CoF6]3- |
Следует отметить, что в гибридизации участвуют не только АО, имеющие неспаренные электроны, но и АО с несвязывающими электронными парами.Молекулой с несвязывающими электронными парами, участвующими в гибридизации, является, например, молекула Н2О. Схема ВС и структурная формула показаны на рисунке 4.8.
В соответствии с диаграммой ВС у атома кислорода имеет место гибридизация sр3-типа. Углы между электронными облаками должны быть 109028/ . Однако на самом деле углы искажаются вследствие не равноценности облаков (см. далее - метод ОЭПВО), и угол НОН составляет 104,50 .
гибридные АО
 |

 2s 2p
2s 2p





 О •• О:
О •• О:




Н Н
1s 1s
Н H
Рис. 4.8.Схема ВС и структурная формула молекулы Н2О
гибридные АО
2s
F F F F-
Рис 4.9.Схема ВС иона BF4- |
Примером участия в гибридизации пустой орбитали является молекулярный ион BF4-. Его образование можно пред-
ставить уравнением
BF3 + F- = [BF4]- ,
причем четвертая связь В-F образуется за счет донорно-акцепторного взаимодействия
(В - акцептор и F- - донор,
рис. 4.9).
В гибридизации участвуют все валентные атомные орбитали
бора, то есть имеет место sp3-гибридизация орбиталей атома бора. Молекулярный ион имеет тетраэдрическое строение, причем все углы равны, несмотря на отличие одной из связей по механизму образования (см. далее – делокализация химических связей).
Типы и степень перекрывания АО соседних атомов. Кратные связи.Основываясь на чисто электростатических соображениях, можно предполагать, что энергия связи будет тем больше, чем плотнее и меньше будет электронное облако, притягивающее соседние ядра (первое правило). Это подтверждается и квантово-механическими расчетами. Кроме того, выявляется, что энергия притяжения атомов убывает для следующих типов перекрывания АО одной оболочки:
s-s > s-p > p-p > p-d........
Это связано с тем, что энергии АО и размеры электронного облака возрастают с увеличением квантового числа l (первое правило).
Различают такое перекрывание и соответствующие ему типы связей по элементам симметрии, которые характеризуются молекулярными квантовыми числами l = 0, 1, 2.... и которые обозначают, подобно атомным квантовым числам l , символами, s, p и d (аналоги s, p и d).
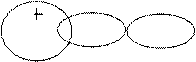
Второе правило, определяющее возможность образования связи, состоит в том, что перекрывающиеся АО должны быть одинаковой симметрии относительно оси связи. Так, например, перекрывание s- и р-АО
может привести к образованию связи , если р-АО вытянута вдоль оси связи (рис. 3.10, а), и не образуется, если р-АО перпендикулярна линии связи (рис. 3.10, вариант б).
+
+ -
Рис. 4.10.Схема перекрывания АО - симметричного (а) и несимметричного (б) -относительно линии связи х |
Третье правило: для образования прочной связи необходимо, чтобы перекрывающиеся атомные орбитали были как можно ближе по энергии. Поэтому-то рассматривают участие в образовании химических связей только валентных электронов.
Таким образом,s-связями(перекрыванием) называют связи (перекрывание), образующиеся при перекрывании АО, имеющих цилиндрическую симметрию относительно линии связи (знак и величина волновой функции не изменяются при повороте на любой угол), рис. 3.11.
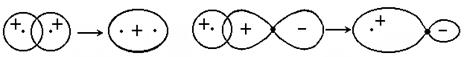
Перекрывание s + s s + p
Тип связи (а) sss (связ.) (б) ssp(связ.)
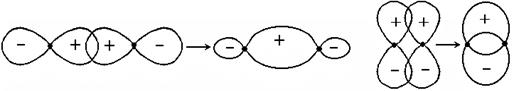
(г) рх + рх sрр (связ.) (д) pу + рypрр(связ.)
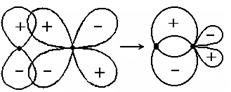
(е) py + dyppd(связ.)
Рис. 4.11.Некоторые типы перекрывания АО, формы и типы
химических связей
Между двумя атомами, в соответствие с рассматриваемым методом ВС, может быть только одна связь s-типа.
p-связью (перекрыванием) называют связь, образующуюся при перекрывании облаков, имеющих плоскость симметрии, но не имеющих цилиндрической симметрии. В этом случае электронные плотности располагаются вне линии связи с двух ее сторон; таких связей между двумя атомами может быть несколько. Например, если Х - линия связи, то возможно образование двух одинаковых pр-р -связи в результате перекрывания рy-рy и рz-рz(такие связи будут иметь одинаковую энергию, поэтому говорят, что pр-р-связи дважды вырожденны) (рис. 4.11, д).
Существует также редко встречающаяся d-связь, которая образуется при перекрывании d-АО соседних атомов сразу 4-мя лепестками; плохо изучены также химические связи, образующиеся при перекрывании f-орбиталей.
Таким образом, если возвратиться к схеме ВС молекулы СО
(рис. 3.3), то можно сказать, что между атомами существует тройная связь: одна s-связь осуществляется за счет перекрывания 2рх-2рх орбиталей атомов С и О (как на рис. 4.11, г) и две p-связи: одна из них образуется за счет 2рy-2рy перекрывания и лежит в плоскости ХY, а вторая - за счет 2рz-2рz - лежит в плоскости ХZ; две p-связи совершенно одинаковы по перекрыванию, следовательно, и по энергии.
Энергия, кратность и длина связи.Эти характеристики взаимозависимы: чем больше кратность, тем меньше длина и больше энергия связи; при одинаковой кратности - чем меньше длина, тем больше энергия связи.
Ординарная связь образуется одной электронной парой, причем электронная плотность в основном сосредоточена между атомами на оси связи (сигма-связь), рис. 4.11. Вторая связь, образованная второй электронной парой, должна располагаться вне линии связи, так как понятие орбиталь включает в себя и пространство, в котором движется электрон, а благодаря принципу исключения Паули на ней не может быть более 2-х электронов с противоположными спинами. Очевидно, что количество связей между двумя атомами не может быть большим - обычно не более 3-х. Кроме того, можно заключить, что вторая связь слабее первой, так как ее протяженность больше, а электронная плотность — меньше. Однако суммарная энергия кратной связи больше, чем ординарной. Длина же кратной связи уменьшается с увеличением ее кратности.
Пример 1. Какая из молекул прочнее: Сl2, О2 ?
Решение. Простейший ответ состоит в следующем: валентные электроны атомов хлора и кислорода имеют следующие электронно-графические формулы:
O .. . 2s2 2p4 Cl.... 3s2 3 р5

Таким образом, в молекуле Cl2 может образоваться одна связь (один неспаренный электрон), получаемая перекрыванием двух р-орбиталей: Px-Px (рис. 3.11, г). У атома кислорода имеется два неспаренных электрона в р-состоянии, т.е. в молекуле О2 могут образоваться две связи (кратность равна двум), одна из них s-типа
(Px-Px), а другая - p (электронная плотность с двух сторон от линии связи х). Следовательно, молекула О2 прочнее (т.к. кратность связи больше) молекулы Cl2.
Следует отметить, что, хотя сделанный выше вывод качественно верен, однако установлено (см. далее метод МО), что: 1) схема ВС правильно даёт кратность связи, но неверно описывает магнитные свойства молекулы О2; 2) в случае Cl2 возможно образование донорно-акцепторных связей за счёт пустых валентных d-АО и несвязывающих электронных пар. За счёт этого кратность связи несколько меньше, а энергия – больше, чем у простой ординарной связи.
Пример 2. Как изменяется прочность связи Н-Э в ряду НF®HCl®HBr®HI ?
Решение. Для всех этих молекул схемы ВС одинаковы: имеется одна связь (s-типа - s-px), и нет условий для образования других связей; поэтому та молекула будет прочнее, у которой длина связи будет наименьшей. В указанном ряду атомные радиусы ионов Г- возрастают, что приводит к увеличению длины связей и их ослаблению. Таким образом, при переходе от фтора к йоду прочность связи Н-Э уменьшается (565, 431, 364, 297 кДж/моль, соответственно).
Делокализация связей.Рассмотрим молекулярный ион СО32- . Из экспериментальных исследований известно, что этот ион имеет плоско- треугольное строение - атом С образует связи с тремя атомами О, углы между связями равны и составляют по 1200 каждый; атомы кислорода не связаны между собой (рис. 3.12, б). При построении схемы ВС учтем, что ион имеет два "лишних" электрона, поэтому изобразим его состоящим из атома С (в возбужденном состоянии), атома О и двух ионов О- . Будем рассматривать сначала более сильно перекрывающиеся АО: ss-p- cвязь с атомом О и две sр-р-связи с двумя ионами кислорода (О-). После этого остались еще два неспаренных электрона: один на 2р-орбитали углерода, второй - на 2р-АО кислорода. Эти АО перпендикулярны s-связям иона СО32- и могут образовать pр-р-связь, как на рисунке 3.11, д.
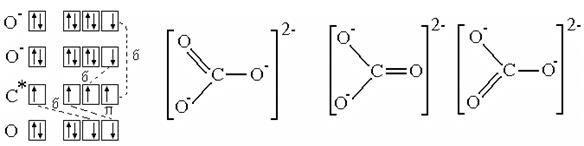 y 1 y 2 y 3
y 1 y 2 y 3
(а) (б)
Рис. 4.12.СхемаВС (а) и структурные формулы (б) иона СО32-
В результате получилась конфигурация, содержащая атом С, имеющий 3s-связи, одну p-связь - с атомом О, содержащая два иона О-. Все связи неравноценны: они должны быть разной длины, не должны быть равны и углы между ними. На самом деле, как доказано экспериментально, все связи, углы и заряды на атомах одинаковы. Для объяснения подобных ситуаций в методе ВС вводитсяпроцедураделокализации, которая состоит в том, что принимаются во внимание другие схемы ВС, подобные схеме (а) на рис 4.12, но с другим порядком расположения атомов и ионов кислорода. Им соответствуют структуры y2 и y3 , и они отличаются от y1 только расположением двойной связи и зарядов на атомах. Волновая функция молекулы получается сложением с равными коэффициентами этих функций:
y = С (y1 + y2 + y3) , что соответствует наложению соответствующих конфигураций.
При этом p-связь и заряды на атомах перераспределяются между ними поровну, то есть делокализуются. В результате доля p-связи на каждом из промежутков С-О становится равной  , а заряды на атомах
, а заряды на атомах
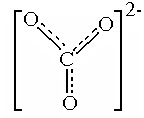
y
кислорода 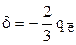 . Валентность (связевая) атома углерода равна 4, а средняя кратность каждой связи С-О равна 1
. Валентность (связевая) атома углерода равна 4, а средняя кратность каждой связи С-О равна 1 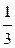 . Длина связи С-О в ионе СО32- равна 0,129 нм и является промежуточной между длиной одинарной (0,143 нм) и двойной (0,122 нм) связей.
. Длина связи С-О в ионе СО32- равна 0,129 нм и является промежуточной между длиной одинарной (0,143 нм) и двойной (0,122 нм) связей.
Пример 3. Объяснить электронное строение молекулы SiF4 методом ВС.
Решение. Электронная конфигурация атома кремния: 1s22s22p63s23p2 .
Для присоединения четырех атомов фтора, каждый из которых имеет по одному неспаренному электрону, атом кремния должен иметь четыре неспаренных электрона. У атома кремния в нормальном состоянии имеется неподеленная пара электронов и есть пустые орбитали. Таким образом при возбуждении атома кремния валентные электроны имеют формулу 3s13p3.
3s 



 3p 3d
3p 3d



 Si*
Si*
Четыре неспаренных электрона возбужденного атома кремния образуют четыре общие электронные пары с четырьмя атомами фтора (2s22p5), имеющими по одному неспаренному электрону, с образованием молекулы SiF4 (рис. 4.13).
гибридные АО
2s
F F F F
Рис. 4.13.Схема ВС молекулы SiF4 |

Из схемы видно, что атом Si образует 4σ-связи; перечисление АО, образующих эти связи, даёт тип гибридизации АО атома кремния: sp3. Этому соответствуют углы между связями 109028' (тетраэдрический угол).
Пример 4.Объяснить электронное строение иона [SiF6]2- методом ВС. Может ли существовать ион [CF6]2-?
Решение. Для образования иона [SiF6]2- к молекуле SiF4 должны присоединиться два иона фтора (F-), электронная формула которого 1s22s22p6, все электроны спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух пустых (вакантных) 3d-орбиталей атома кремния (рис. 3.14). При этом F - донор электронной пары, а атом кремния – акцептор (sp3d2 –гибридизация).
Углерод (1s22s22p2) может образовать, подобно кремнию, соединение СF4, но при этом валентные возможности углерода будут исчерпаны, так как нет неспаренных электронов, неподеленных электронных пар и вакантных орбиталей на валентном уровне.
Таким образом, ион [CF6]2- образоваться не может.
гибридные АО
3s 3p 3d
Рис 4.14. Схема ВС иона [SiF6]2- |
Таким образом, метод ВС имеет следующие преимущества:
1. Соответствие метода химической традиции (молекула состоит из атомов, локализованная связь принадлежит паре атомов).
2. Простота описания сложных молекул с помощью схем ВС и структурных формул.
3.Возможность описания основных типов молекул и взаимодействий, валентности атомов.
Недостатки метода ВС:
1.Громоздкость, неэкономность математического описания.
2. Неверное описание свойств (магнитных, кратности связей, неполное описание геометрии) молекул простыми СВС и необходимость использования в связи с этим искусственных схем.
3. Преувеличение роли локализованных связей.
Недостаток в описании геометрии молекул в значительной степени преодолевается применением относительно простого метода, который приведён далее.
Дата добавления: 2016-07-05; просмотров: 3910;








 3p
3p


 2s 2p
2s 2p



 В*
В*




 2p
2p



 + х (а)
+ х (а)
 +
+

 х (б)
х (б)



 s s s s
s s s s

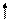







 2s
2s