Ковалентная связь. Теория валентных связей
Общие понятия.Химическая связь, образованная путем обобществления пары электронов двумя атомами, называетсяковалентной.Химическая связь возникает при взаимодействии атомов, при этом происходит понижение энергии системы. Возьмем простейший пример – образование молекулы водорода из атомов.

 Е
Е

 Е3
Е3
кривая 1

 Е2
Е2
 Е1
Е1
r0 r (расстояние между атомами)

 кривая 2
кривая 2
 DЕ
DЕ
 |  | |||
 | ||||
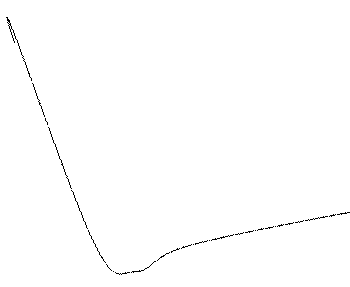
Рис. 4.1.Кривые потенциальной энергии системы из двух атомов
водорода от межъядерного расстояния
По мере сближения атомов, их электроны начинают притягиваться не только ядром своего атома, но и ядром другого атома. Атомные орбитали начинают перекрываться, и появляется вероятность одновременного появления обоих электронов в области перекрывания. Здесь вступает в действие принцип Паули: если спины электронов параллельны, то они стремятся разойтись, между ядрами возникает дополнительное отталкивание и химическая связь не образуется (кривая 1).
Если же спины электронов двух атомов антипараллельны, то принцип Паули не препятствует их совместному пребыванию в межъядерной зоне в области притяжения. Кривая 2 описывает понижение энергии, и в этом случае химическая связь образуется. Система из двух атомов водорода имеет минимальную энергию при некотором расстоянии между атомами r0. При дальнейшем сближении атомов энергия системы снова возрастает за счет увеличения сил отталкивания между ядрами.
Другое объяснение, базирующееся на описании движения электронов, как и в случае атомов, с помощью волновых функций, состоит в том, что при сближении атомов их волновые функции перекрываются. При этом возможно либо увеличение, либо уменьшение электронной плотности (интенсивности электронной волны) – явление аналогично интерференции обычных волн. Увеличение электронной плотности происходит при совпадении знаков волновых функций и при противоположных спинах злектронов.
Валентность, промотирование и схемы ВС.Из расчетов в методе ВС следует, что химическая связь образуется за счет спаривания электронов двух атомов. Таким образом, можно сделать вывод, что валентность атома, по крайней мере частично, определяется числом неспаренных электронов. Например,

 у атома Н такой электрон один (1s1)
у атома Н такой электрон один (1s1)
и валентность Н равна единице;

у атома Не электронов два (1s2),
они спарены и валентность гелия равна нулю;
у атома лития (Li) три электрона (1s22s1), 



 1s 2s
1s 2s
два из них спарены на внутренней оболочке и лишь один неспаренный на валентной оболочке, следовательно, валентность лития равна единице. Приведенные выше соображения соответствуют обычной химической практике: Н и Li одновалентны, а Не не образует химических соединений.
В ряде случаев число неспаренных электронов может увеличиться в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом бериллия в основном состоянии не имеет неспаренных электронов. Все электроны спарены, валентность равна 0. Однако общеизвестна двухвалентность бериллия.
Для объяснения этого в методе ВС вводят представление опромотировании(возбуждении) электронов валентной оболочки: электрон с 2s-АО переходит на пустую 2р-АО. Таким образом, вступая в химическое соединение атом бериллия переходит в возбужденное состояние (Ве*):
2s 2p 2s 2p
 Ве*
Ве*
Be
Энергия возбуждения Ве из состояния 2s2 в состояние 2s12p1 составляет 259 кДж/моль,а при образовании одной химической связи происходит выделение энергии от 160 до 400 кДж. Таким образом, хотя на возбуждение атома бериллия затрачивается энергия, при образовании двух химических связей может выделиться энергии гораздо больше, чем затрачивается. В результате система понижает свою энергию, то есть она становится устойчивее.
Также объясняется трехвалентность бора и четырехвалентность углерода:
2s 2p 2s 2p








 В (1s22s22p1) ® B*
В (1s22s22p1) ® B*
 | |||||||||||||
 |  |  |  |  |  | ||||||||


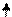
 C (1s22s22p2) ® С*
C (1s22s22p2) ® С*
Возбуждение атомов азота, кислорода и фтора в пределах второго квантового уровня не может привести к увеличению числа неспаренных электронов (N - 2s22p3; O - 2s22p4; F - 2s22p5 - все орбитали заняты). Возбуждение электронов в этих атомах, связанное с их перемещением на следующий, третий, квантовый уровень, требует значительно большей энергии, чем та, которая выделяется при образовании дополнительных связей. Поэтому, например, соединения четырехвалентного кислорода должны быть крайне неустойчивы.
Образование химических связей в методе ВС изображают с помощью схем ВС. Например, для молекулы СН4 и СО (рис. 4.2 и 4.3):
 2s 2p 2s 2p
2s 2p 2s 2p


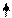


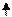

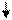






 С* C Акц-р
С* C Акц-р
 |  |  |  |
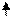
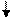
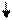
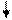
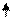
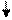
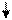
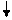



 4H O Донор
4H O Донор
1s 1s 1s 1s 2s 2p
Рис. 4.2.Схема ВС для Рис. 4.3.Схема ВС
молекулы СН4 для молекулы СО
Приведённым схемам ВС соответствуют структурные формулы (СФ) (рис. 4.4), на которых связывающие электронные пары изображают чёрточками (валентная черта), а несвязывающие электроны – точками. Кроме того, на СФ могут быть указаны обозначения элементов геометрии молекулы и/или связей.
Н

 С
С
Н : 
 С ≡ О:
С ≡ О:
Н Н
Рис. 4.4. Структурные формулы для молекул СН4 и СО
Рассмотренный в случае молекулы СН4 механизм образования ковалентной связи (рис. 4.2) называют обменным.
Донорно-акцепторное взаимодействие.Рассмотрим далее схему ВС молекулы СО (рис. 4.3). Если учитывать только спаривание электронов атомов С и О, то образуется две связи (С=О); однако энергия связи в этой молекуле превышает обычные значения энергии двух связей, и она даже больше, чем в молекуле N2 , в которой тройная связь. Для объяснения этого факта в методе ВС вводится представление о донорно-акцепторной связи. В случае молекулы СО она образуется за счет электронной пары валентной оболочки атома кислорода и пустой АО атома углерода. Атом кислорода при этом называютдонором, а углерода - акцепторомэлектронной пары.
Дата добавления: 2016-07-05; просмотров: 1686;











