В атоме. Квантовые числа
СТРОЕНИЕ ВЕЩЕСТВА
Строение вещества - учение о том, какие силы определяют его состав и структуру. В случае химии состав и структура определяются на уровне атомов и молекул, а действующие между ними силы определяются взаимодействием заряженных элементарных частиц - электронов и протонов.
При изучении строения вещества принята естественная последовательность: сначала изучают строение атомов, а затем - строение состоящих из них молекул и немолекулярных веществ, то есть химическую связь между атомами.
Глава 2. Строение атома
Корпускулярно-волновое описание движения электрона
в атоме. Квантовые числа
До конца ХIХ века полагали, что атом – неделимая и неизменяющаяся частица. Открытие радиоактивности урана и некоторых других элементов (А. Беккерель, 1896 г.) и объяснение её расщеплением ядер атомов (Э. Резерфорд, Ф. Содди, 1903 г.), а также открытие электрона, как составной части атома (Дж. Стоней, 1881 г; Дж. Томсон, 1897 г.), доказали сложное строение атома.
Было экспериментально доказано (Э. Резерфорд, 1911 г.), что атом состоит из положительно заряженного тяжелого ядра, имеющего размеры порядка 10-6 нм и легкой оболочки из отрицательно заряженных электронов, имеющей размеры порядка 10-1 нм (т.е. в 100000 раз больше, чем ядро); масса ядра примерно в 2000 раз больше массы электронов, а заряды ядра и электронной оболочки равны между собой.
Ядро атома, в свою очередь, состоит из положительно заряженных частиц - протонов (p) и незаряженных частиц - нейтронов (n), имеющих примерно одинаковые массы (табл. 2.1). При этом абсолютные величины зарядов частиц принято выражать в единицах заряда электрона - 1,602·10-19Кл = 1 ед. заряда.
Таблица 2.1
Свойства элементарных частиц
| Частица (символ) | Местоположение в атоме | Относительный заряд | Относительная масса (а.е.м.) |
| Протон (p) | в ядре | +1 | 1,00728 |
| Нейтрон (n) | в ядре | 1,00867 | |
Электрон ( 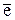 ) )
| в оболочке | -1 | 0,00055 |
Природа элемента, его основные химические свойства определяются числом протонов в ядре, равным его заряду Z. Атомы, имеющие одинаковый заряд ядра (или число протонов в ядре), относятся к одному и тому же элементу. Атомы одного и того же элемента, имеющие одинаковый заряд ядра, но различное число нейтронов в ядре (N), называются изотопами. Например, изотопами элемента кальция являются 4020Ca (20p + 20n), 4220Ca (20p+22n) и 4320Ca (20p+23 n).
Обратите внимание: состав ядра изотопа указывается цифрами перед символом элемента. При этом верхний индекс обозначает общее число протонов и нейтронов (нуклонов). Сумму протонов (Z) и нейтронов (N), содержащихся в ядре атома, называют массовым числом(А). Нижний индекс обозначает число протонов (Z), а разность между ними равна числу нейтронов N = A - Z. Сумма масс протонов и нейтронов атомного ядра всегда несколько больше, чем масса ядра. Например, масса ядра изотопа 42He, содержащего два протона и два нейтрона, составляет 4,001506 а.е.м., а сумма масс этих четырех нуклонов равна 4,031882. Разница (дефект массы) составляет 0,030376 а.е.м. Дефект массы определяет устойчивость атомных ядер и энергию связи нуклонов в ядре. Он соответствует энергии, которая выделяется при образовании ядра из протонов и нейтронов и может быть рассчитана по уравнению Эйнштейна:
E = mc2,
где m - масса (кг), c - скорость света (3·10 м.с-1 ).
Так как 1 а.е.м. = 1,6605655·10-27 кг, то легко подсчитать, что при образовании ядра атома гелия выделяется огромное количество энергии (28,2 МэВ » 2,8.109 кДж/моль ядер), что в миллионы раз больше, чем при образовании химической связи.
В настоящее время для всех элементов известны изотопы: всего около 300 устойчивых и более 1400 неустойчивых (радиоактивных). Определяют их по массам (масс-спектрометрия), а радиоактивные – по спектрам излучения.
Исследования, проведенные в конце ХIХ века и начале ХХ, показали неприменимость законов классической физики для описания поведения микрообъектов. На основе этих исследований была создана новая наука - квантовая (волновая) механика, в основе которой лежат представления о квантовании энергии и двойственной (корпускулярно-волновой) природе микрочастиц.
Дата добавления: 2016-07-05; просмотров: 1460;











