Инсулин: строение, молекулярные механизмы и механизм действия на метаболические процессы.
Строение инсулина
Инсулин — полипептид, состоящий из двух цепей. Цепь А содержит 21 аминокислотный остаток, цепь В — 30 аминокислотных остатков. В инсулине 3 дисульфидных мостика, 2 со-единяют цепь А и В, 1 соединяет 6 и 11 остатки в А цепи.
Инсулин может существовать в форме: мономера, димера и гексамера. Гексамерная струк-тура инсулина стабилизируется ионами цинка, который связывается остатками Гис в поло-жении 10 В-цепи всех 6 субъединиц.
Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека. Бычий инсулин отличается от инсулина человека на 3 аминокислоты, а инсулин свиньи отличается только на 1 аминокислоту (ала вместо тре на С конце В-цепи).
Во многих положениях А и В цепи встречаются замены, не оказывающие влияния на био-логическую активность гормона. В положениях дисульфидных связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и N-концевых остатков А-цепи замены встречаются очень редко, т.к. эти участки обеспечивают формирование активного центра ин-сулина.
Биосинтез инсулина включает образование двух неактивных предшественников, препроинсу-лина и проинсулина, которые в результате последовательного протеолиза превращаются в ак-тивный гормон.
1. На рибосомах ЭПР синтезируется препроинсулин (L-В-С-А, 110 аминокислот), биосин-тез его начинается с образования гидрофобного сигнального пептида L (24 аминокислот), ко-торый направляет растущую цепь в просвет ЭПР.
2. В просвет ЭПР препроинсулин превращается в проинсулин при отщеплении эндопеп-тидазой I сигнального пептида. Цистеины в проинсулине окисляются с образованием 3 ди-сульфидных мостиков, проинсулин становиться «сложным», имеет 5% активности от инсу-лина.
3. «Сложный» проинсулин (В-С-А, 86 аминокислот) поступает в аппарат Гольджи, где под действием эндопептидазы II расщепляется с образованием инсулина (В-А, 51 аминокислот) и С-пептида (31 аминокислота).
4. Инсулин и С-пептид включаются в секреторные гранулы, где инсулин соединяется с цинком, образуя димеры и гексамеры. В секреторной грануле содержание инсулина и С-пептида составляет 94%, проинсулина, интермедиатов и цинка - 6%.
5. Зрелые гранулы сливаются с плазматической мембраной, а инсулин и С-пептид попадают во внеклеточную жидкость и далее в кровь. В крови олигомеры инсулина распадаются. За сутки в кровь секретируется 40-50 ед. инсулина, это составляет 20% от его общего запаса в поджелудочной железе. Секреция инсулина энергозависимый процесс, происходит с участием микротубулярно-ворсинчатой системы.
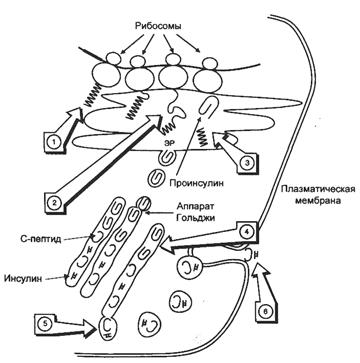
Схема биосинтеза инсулина в β-клетках островков Лангерганса
ЭПР — эндоплазматический ретикулум. 1 — образование сигнального пептида; 2 — синтез препроинсулина; 3 — отщепление сигнального пептида; 4 — транспорт проинсулина в аппарат Гольджи; 5 — превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 — секреция инсулина и С-пептида.
Ген инсулина находиться в 11 хромосоме. Выявлены 3 мутации этого гена, у носителей низкая активность инсулина, отмечается гиперинсулинемия, нет инсулинорезистентности.
Дата добавления: 2016-06-29; просмотров: 4227;











