Исследование минерализатов на наличие висмута
Для обнаружения висмута в минерализатах вначале выполняют предварительные реакции на ионы этого металла с тиомочевиной и оксином (8-оксихинолином). При положительном результате этих реакций висмут выделяют из минерализата в виде диэтилдитиокарбамата, который экстрагируют хлороформом. После прибавления кислоты к хлороформной вытяжке происходит разложение диэтилдитиокарбамата висмута. Образовавшиеся при этом ионы висмута переходят в водную фазу, которую используют для обнаружения указанных ионов при помощи соответствующих реакций.
Реакция с тиомочевиной. При взаимодействии ионов висмута с тиомочевиной могут образовываться различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску:
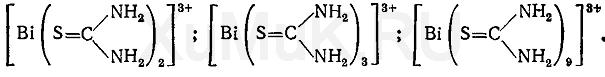
Реакции образования тиомочевинных комплексов висмута мешают окислители.
Выполнение реакции. В пробирку вносят 5 мл минерализата и прибавляют 3—5 мл насыщенного водного раствора тиомочевины. При наличии ионов висмута раствор приобретает лимонно-желтую окраску. Предел обнаружения: 0,4 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Реакция с оксином основана на переведении ионов висмута в ацидокомплекс [ВiI 4 ] -, который при взаимодействии с оксином в кислой среде образует оранжево-красный осадок, представляющий собой ионный ассоциат (иодвисмутат оксина). Образование этого ионного ассоциата можно представить следующими уравнениями:
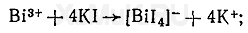
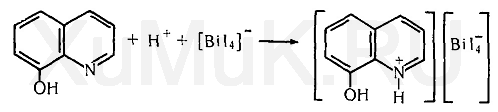
Этой реакции мешают окислители, которые выделяют иод из иодида калия, применяемого для получения ацидокомплекса [BiI 4 ] -. Кроме этого, реакции образования иодвисмутата оксина мешают катионы ряда металлов, которые дают осадки с оксином. Для маскировки мешающих ионов к смеси реагирующих веществ добавляют аскорбиновую кислоту, которая восстанавливает ионы железа (III), и сегнетовую соль, связывающую другие ионы, мешающие обнаружению висмута.
Выполнение реакции.В пробирку вносят 10 мл минерализата, прибавляют по 0,5 г аскорбиновой кислоты, сегнетовой соли и иодида калия. При этом появляется интенсивно-желтая окраска (образуется иодвисмутат), которая не должна переходить в синюю от прибавления капли раствора крахмала. При появлении синей окраски к смеси реагирующих веществ по каплям прибавляют 10 %-й раствор тиосульфата натрия до исчезновения этой окраски. После этого по стенкам пробирки к смеси, имеющей желтую окраску, осторожно прибавляют 1—2 мл 2 %-го раствора оксина в 2 н. соляной кислоте. На границе соприкосновения раствора оксина и находящейся в пробирке жидкости через 1— 2 мин появляется оранжево-желтый осадок иодвисмутата оксина.
Если в исследуемой пробе содержится незначительное количество ионов висмута, то указанный осадок может появиться только через 30—60 мин. Поэтому, не дожидаясь образования осадка, содержимое пробирки переносят в делительную воронку, в которую прибавляют 3 мл смеси равных объемов ацетона и амилацетата, а затем взбалтывают. При наличии ионов висмута в минерализате слой органических растворителей (ацетон— амилацетат) приобретает оранжево-розовую окраску. Предел обнаружения: 5 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Описанные выше реакции на висмут с тиомочевиной и оксином являются предварительными. Отрицательный результат этих реакций указывает на отсутствие ионов висмута в минерализате. При положительном результате указанных выше реакций производят дальнейшее исследование минерализата на наличие ионов висмута. С этой целью ионы висмута выделяют из минерализата в виде комплекса с диэтилдитиокарбаминатом натрия.
Этот комплекс экстрагируют хлороформом, а затем разлагают кислотой.
Выделение ионов висмута из минерализата.К минерализату прибавляют раствор диэтилдитиокарбамата натрия. При этом ионы висмута с этим реактивом образуют внутрикомплексное соединение:
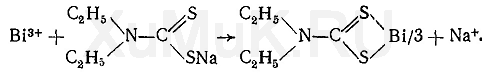
Кроме ионов висмута с диэтилдитиокарбаматом натрия дают внутрикомплексные соединения и некоторые другие ионы, которые могут содержаться в минерализате. Для маскировки этих ионов прибавляют раствор комплексона III (трилона Б). Образовавшийся комплекс диэтилдитиокарбамата висмута экстрагируют хлороформом, а затем разлагают азотной кислотой.
В делительную воронку вносят 10 мл минерализата, 0,1 г комплексона III и несколько капель 0,1 %-го спиртового раствора нильского голубого (см. Приложение 1, реактив 24), являющегося индикатором. К этой смеси прибавляют 3 н. раствор гидроксида натрия до рН=12 (до перехода синей окраски индикатора в розовую). После доведения содержимого делительной воронки до необходимого рН к жидкости еще прибавляют 2—3 мл 3 н. раствора гидроксида натрия, а затем в делительную воронку вносят 3 мл 1 %-го раствора диэтилдитиокарбамата натрия (в смеси равных объемов этилового спирта и воды) и 5 мл хлороформа. Содержимое делительной воронки взбалтывают в течение 0,5 мин, а затем хлороформный слой отделяют в другую делительную воронку. Для промывания хлороформного слоя к нему прибавляют 5 мл 0,3 н. раствора гидроксида натрия и взбалтывают. После взбалтывания хлороформного слоя с раствором щелочи отделяют водную фазу. Хлороформный слой, содержащий диэтилдитиокарбамат висмута, переносят в делительную воронку, прибавляют 3 мл 4 н. раствора азотной кислоты. Содержимое делительной воронки взбалтывают в течение 1 мин и отделяют хлороформный слой, который в дальнейшем не исследуют. Водную фазу подвергают исследованию на наличие ионов висмута при помощи реакций с бруцином, хлоридом цезия и тиомочевиной.
Реакция с бруциноми бромидом калия.На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят каплю 2 н. раствора азотной кислоты, а затем прибавляют каплю насыщенного раствора бруцина в 1 н. серной кислоте и каплю 5%-го раствора бромида калия. При наличии ионов висмута сразу же или через несколько минут образуются желто-зеленые кристаллы, собранные в виде сфероидов.
Реакция с хлоридом цезия и иодидом калия.На предметное стекло наносят несколько капель водной фазы, которую выпаривают досуха. На сухой остаток наносят 1—2 капли 3 н. раствора соляной кислоты. Затем с одной стороны жидкости на предметном стекле помещают кристаллик хлорида цезия CsCl, а с другой — кристаллик иодида калия. Нанесенные кристаллики реактивов с помощью тонкой стеклянной палочки соединяют с жидкостью. При наличии ионов висмута в растворе образуются оранжево-красные кристаллы Cs[BiI 4 ], имеющие форму шестиугольников или шестилучевых звездочек. Предел обнаружения: 0,1 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Реакция с тиомочевиной.В пробирку вносят 0,5 мл водной фазы, к которой прибавляют 0,5 мл насыщенного раствора тиомочевины. В присутствии ионов висмута появляется лимонно-желтая окраска.
СОЕДИНЕНИЯ КАДМИЯ
Все объявления
ЯндексДирект
Дать объявление
- Низкотемпературные камеры
низкотемпературные морозильники с температурным режимом -24С, -55С, -85С
Адрес и телефон · www.winecoolers.ru
Применение и токсичность соединений кадмия.Кадмий применяется в промышленности для получения легкоплавких сплавов, для замены висмута в типографском шрифте или для замены олова при эмалировании посуды. Сульфид кадмия является одним из компонентов светящихся красок, используется для росписи на фарфоре и т. д. Сульфат кадмия также применяется для изготовления красок. Другие соединения кадмия (хлорид, бромид, иодид, нитрат, карбонат, ацетат) применяются в гальванотехнике, керамике, они входят в состав средств для чистки изделий из серебра. Ряд растворимых соединений кадмия применяется в химических лабораториях в качестве реактивов.
Металлический кадмий и его оксид, применяемые в технике для получения сплавов, при высокой температуре могут улетучиваться и попадать в организм с вдыхаемым воздухом. Пары металлического кадмия и его оксида являются токсичными. Известны бытовые отравления соединениями кадмия. При изготовлении фруктовых соков, варенья в посуде, в состав эмали которой входит кадмий, он может реагировать с кислотами, содержащимися в фруктах. При этом образуются соли, оказывающие токсическое действие на организм.
Незначительные количества кадмия являются составной частью некоторых клеток и тканей организма (см. табл. 7).
Всасывание соединений кадмия происходит через пищевой канал, а паров — через дыхательные пути. Растворимые соединения кадмия денатурируют белки, содержащиеся в стенках пищевого канала. Поступившие в кровь ионы кадмия соединяются с сульфгидрильными группами ферментов, нарушая их функции. Соединения кадмия накапливаются главным образом в печени и почках. Они могут вызывать жировое перерождение печени. Соединения кадмия выделяются из организма в основном через почки с мочой и стенками кишок. В ряде случаев при отравлении соединениями кадмия отмечается кишечное кровотечение.
Дата добавления: 2016-06-29; просмотров: 2188;











