МЕТОД МИКРОДИФФУЗИИ
Метод микродиффузии широко используется в биохимических и некоторых токсикологических лабораториях для обнаружения химических соединений, имеющих большую упругость паров. Этот метод применяется в судебно-химических лабораториях в зарубежных странах. В судебно-химических лабораториях СССР этот метод не нашел широкого применения. В нашей стране рекомендован к применению только агар-диффузионный метод обнаружения фосфорорганических пестицидов в трупном материале, являющийся одной из модификаций метода микродиффузии.
Внедрение метода микродиффузии в практику судебно-химических лабораторий может облегчить выполнение ряда экспертиз, связанных с отравлениями некоторыми ядами.
Для обнаружения исследуемых веществ методом микродиффузии применяют чашки Конвея или подобные им сосуды, в которых летучие вещества из исследуемых объектов сначала переходят в пространство прибора, а затем в соответствующий растворитель или в раствор реактивов, реагирующих с определяемыми веществами.
Метод микродиффузии имеет ряд достоинств. Он позволяет обнаружить летучие вещества, содержащиеся в небольших количествах исследуемых объектов. При использовании этого метода не образуется пена (что возможно при перегонке летучих ядовитых веществ с водяным паром), определяемые вещества не подвергаются сильному разбавлению и г. д.
Скорость диффузии зависит от упругости пара исследуемого вещества, объема пробы, температуры, состава поглощающих жидкостей и т. д. На скорость перехода отдельных летучих веществ из исследуемых объектов в пространство прибора для микродиффузии влияют некоторые электролиты. Так, например, прибавление насыщенного раствора карбоната калия к крови, моче и гомогенатам тканей, содержащих этиловый спирт, ускоряет переход этого спирта в пространство прибора. Для ускорения перехода других соединений из исследуемых объектов в пространство прибора прибавляют кислоты, щелочи и др.
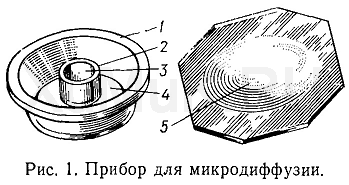
Прибор для микродиффузии (рис. 1) представляет собой небольшой круглый толстостенный сосуд 1 из стекла или пластмассы (наружный диаметр 60—70 мм, высота 10 мм). Внутри этого сосуда расположен второй круглый сосуд 2 меньшего размера (диаметр 30—35 мм, высота 5 мм). Таким образом, в приборе для микродиффузии имеется внутренняя круговая 3 и наружная кольцевая 4 камеры. Верхний край наружной камеры должен пришлифовываться так, чтобы к нему плотно прилегала крышка 5.
Для создания герметичности в приборе края наружной камеры слегка смазывают вазелином или силиконовой смазкой и плотно прижимают крышку.
Исследуемые объекты вносят в наружную кольцевую камеру, а поглощающую жидкость — во внутреннюю камеру. К. исследуемым объектам, находящимся в наружной камере прибора, на расстоянии 2—3 см помещают раствор вещества, способствующего переходу исследуемого соединения из объекта в пространство прибора. Затем прибор плотно закрывают крышкой и слегка наклоняют его для смешивания исследуемого объекта и раствора, способствующего переходу исследуемого вещества в пространство прибора. После этого прибор оставляют на определенное время, необходимое для диффузии. После окончания диффузии определяют исследуемое вещество в жидкости, находящейся во внутренней камере.
Методика обнаружения отдельных летучих соединений с помощью метода микродиффузии описана ниже.
Обнаружение формальдегида. В наружную камеру прибора для микродиффузии вносят 3 мл крови или мочи, или 1 г гомогената тканей. Затем в ту же камеру вносят 3—4 капли 10 %-го раствора серной кислоты. Во внутреннюю камеру прибора вносят 3,3 мл 0,15 Μ раствора гидросульфита или сульфита натрия. Прибор плотно закрывают крышкой и оставляют на 4 ч при комнатной температуре. После этого жидкость, находящуюся во внутренней камере прибора, исследуют на наличие формальдегида.
Из внутренней камеры прибора берут 1 мл жидкости, которую вносят в пробирку, и прибавляют 9 мл воды. Пробирку охлаждают ледяной водой, а затем прибавляют 0,2 мл свежеприготовленного 0,5%-го раствора хромотроповой кислоты и 4 мл концентрированной серной кислоты. Жидкость хорошо взбалтывают и нагревают на кипящей водяной бане в течение 15 мин, а затем охлаждают. О наличии формальдегида в исследуемой пробе свидетельствует появление розовой или фиолетовой окраски.
Обнаружение альдегида уксусной кислоты. Наружную и внутреннюю камеры прибора заполняют так, как и при обнаружении формальдегида методом микродиффузии. Время микродиффузии 4 ч.
Через 4 ч в пробирку вносят 1 мл жидкости, взятой из внутренней камеры прибора, прибавляют 9 мл воды, 1 каплю 4 %-го раствора сульфата меди, 6 мл концентрированной серной кислоты и 0,2 мл 1 %-го раствора n -гидроксидифенила в 0,5 н. растворе гидроксида натрия. После прибавления каждого реактива жидкость в пробирке хорошо взбалтывают, затем пробирку нагревают в течение 1,5 мин на кипящей водяной бане и охлаждают. При наличии альдегида уксусной кислоты в исследуемых объектах жидкость приобретает фиолетовую окраску. Такую же окраску дает и формальдегид.
Обнаружение ацетона. Заполнение наружной и внутренней камеры производят так, как при исследовании формальдегида. Время микродиффузии 4 ч.
После окончания микродиффузии из внутренней камеры прибора берут 1 мл жидкости и переносят ее в пробирку, в которую прибавляют 9 мл воды, 4 мл 40 %-го раствора гидроксида натрия, 1 мл 20 %-го свежеприготовленного раствора салицилового альдегида в этиловом спирте. Пробирку в течение трех минут нагревают на водяной бане (при 50—60 °С), а затем охлаждают до комнатной температуры. При наличии ацетона в пробе появляется красная окраска.
Обнаружение метилового спирта. Этот метод основан на окислении метилового спирта до формальдегида. При взаимодействии формальдегида с хромотроповой кислотой появляется фиолетовая окраска (см. гл.IV, § 7).
В наружную камеру прибора для микродиффузии вносят 1 мл крови или мочи либо 1 г гомогената ткани. Затем в наружную камеру вносят 1 мл насыщенного раствора карбоната калия. Во внутреннюю камеру прибора вносят 3 мл 10%-го раствора серной кислоты. Прибор закрывают крышкой и оставляют на 3 ч. При исследовании гомогената ткани время диффузии увеличивается до пяти часов.
К 1 мл раствора, взятого из внутренней камеры, прибавляют ] каплю 5%-го раствора перманганата калия и оставляют на 10 мин, а затем прибавляют 1—2 капли насыщенного раствора гидросульфита или сульфита натрия. После исчезновения окраски перманганата калия к жидкости прибавляют 0,2 мл 0,5 %-го раствора хромотроповой кислоты в концентрированной серной кислоте. Жидкость в пробирке охлаждают в ледяной воде, а затем прибавляют 4 мл концентрированной серной кислоты и нагревают пробирку на кипящей водяной бане в течение 15 мин.
Появление красной или фиолетовой окраски жидкости указывает на наличие метилового спирта в исследуемой пробе. Эту пробу выполняют тогда, когда в исследуемом объекте отсутствует формальдегид.
Определение этилового спирта. Во внешнюю камеру прибора для микродиффузии вносят 0,8 мл крови или мочи либо 4 мл гомогената ткани и 1 мл насыщенного раствора карбоната калия. Во внутреннюю камеру вносят 2 мл раствора дихромата калия в серной кислоте. Сосуд плотно закрывают крышкой и оставляют на 3 ч при комнатной температуре. При исследовании гомогената ткани сосуд оставляют на 4 ч при 37 °С или же на 12 ч при комнатной температуре. Появление зеленой или зеленовато-оранжевой окраски жидкости во внутренней камере указывает на наличие этилового спирта в исследуемом объекте. Эта проба не специфична на этиловый спирт. Подобную окраску дают и другие вещества, окисляющиеся дихроматом калия.
Приготовление раствора дихромата калия(см. Приложение 1, реактив 13).
Обнаружение сульфидов.В наружную камеру прибора для микродиффузии вносят 2—4 мл крови или мочи, или же 1 г гомогената ткани. Затем в ту же камеру вносят 3—4 капли 10 %-го раствора серной кислоты. Во внутреннюю камеру прибора вносят 3,3 мл 0,1 н. раствора гидроксида натрия. Прибор плотно закрывают крышкой и оставляют на 3—4 ч при комнатной температуре. Затем из внутренней камеры берут 1 мл жидкости, к которой прибавляют 1 мл раствора нитрата висмута в уксусной кислоте и 3 мл воды. При наличии сульфидов в исследуемых объектах появляется коричнево-черная окраска или такого же цвета осадок сульфида висмута.
Приготовление раствора нитрата висмута(см. Приложение 1, реактив 25).
Обнаружение фенолов.Наружную и внутреннюю камеры прибора для микродиффузии заполняют так, как и при исследовании сульфидов. Через 3—4 ч определяют наличие фенолов.
К 1 мл жидкости, взятой из внутренней камеры прибора, прибавляют 2—3 мл 10 %-го раствора гидроксида натрия и 0,5 мл фенолового реактива Фолина-Чиокальто, разбавленного водой (1:3). При наличии фенолов появляется синяя окраска.
Приготовление реактива(см. Приложение 1, реактив 43).
Обнаружение цианидов. Внаружную камеру прибора для микродиффузии вносят 2—4 мл крови или мочи, или же 1 г гомогената ткани. Затем в ту же камеру вносят 3—4 капли 10%-го раствора серной кислоты. Во внутреннюю камеру прибора вносят 3,3 мл 0,1 н. раствора гидроксида натрия. Прибор плотно закрывают крышкой и оставляют на 3—4 ч при комнатной температуре. Затем из внутренней камеры прибора берут 1 мл жидкости, к которой прибавляют 1 мл 0,1 н. раствора гидроксида натрия, 2 мл 1 н. раствора двузамещенного фосфата натрия и 1 мл 0,25 %-го раствора хлорамина Т. Жидкость взбалтывают и через 2—3 мин прибавляют 3 мл реактива, содержащего барбитуровую кислоту и пиридин. Смесь взбалтывают и оставляют на 10 мин. Появление красной окраски указывает на наличие цианидов в исследуемой жидкости.
Приготовление реактива(см. Приложение 1, реактив 1).
Приготовление свежеперегнанного пиридина(см. Приложение 1, реактив 27).
Определение оксида углерода (II).Во внешнюю камеру прибора вносят 1 мл крови и 1 мл 10 %-го раствора серной кислоты. Во внутреннюю камеру помещают 2 мл 0,1 %-го раствора хлорида палладия в 0,1 н. растворе соляной кислоты. Прибор плотно закрывают крышкой и оставляют на 1 ч при комнатной температуре. При наличии оксида углерода (II) в крови во внутренней камере появляется серебристая пленка металлического палладия:
СО + PdCl 2 + Н 2 О ---> Pd + 2НС1 + СО 2
Дата добавления: 2016-06-29; просмотров: 2707;











