Зрительное восприятие
Органы зрения представляют собой высокоразвитые рецепторы, в основе функционирования которых лежат фотохимические реакции светочувствительных пигментов (фоторецепторов). Для улавливания наибольшего количества света фоторецепторами светочувствительные клетки глаза (палочки и колбочки сетчатки) устроены особым образом: их внешние сегменты буквально «напичканы» специализированными мембранами, в которых и находятся рецепторные молекулы (рис. 13.8). Каждая такая клетка соединяется с помощью посредника с аксонами зрительного нерва, в мембранах которых в результате каскадных реакций в ответ на фотохимические превращения фоторецепторов возбуждаются нервные импульсы. Таким образом, свет различной длины волны, отражаемый объектами, расположенными на различном расстоянии, воспринимается глазом и преобразуется в нервные импульсы. По аксонам зрительного нерва эти импульсы поступают в особый отдел головного мозга (зрительную кору) и интерпретируются там, порождая изображение.
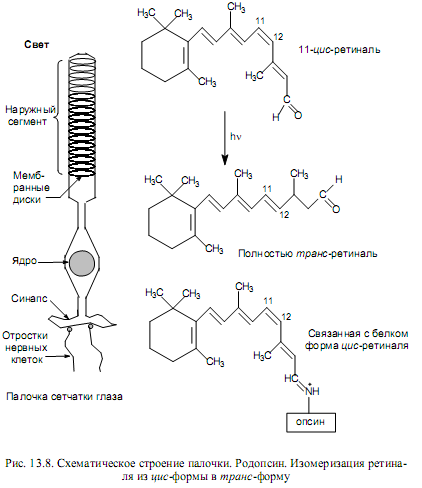
В палочках (высокочувствительные клетки сетчатки, отвечающие за «черно-белое» зрение), в их внешнем, обращенном к окружающей среде сегменте, располагается порядка 500 параллельно уложенных дисков диаметром ~2 мкм (рис. 13.8). Каждый диск образован парой мембран, разделенных узким пространством. Мембраны на 60% состоят из белка, основная часть которого приходится на родопсин — светочувст-вительный хромопротеин. Хромофором родопсина служит 11-цис-ретиналь, он через e-аминогруппу остатка лизина связан с белковой частью — опсином (рис. 13.8). Родопсин присутствует в мембранах дисков в виде трансмембранного белка.
При поглощении молекулой родопсина кванта света происходит изомеризация 11-цис-ретиналя в полностью транс-ретиналь (рис. 13.8). В результате этой фотохимической реакции родопсин переходит в активную форму и стимулирует G-белок, циркулирующий в цитоплазме палочек. В свою очередь, G-белок запускает каскад передачи сигнала, который и приводит к генерированию нервного импульса в мембранах нервных клеток.
Транс-ретиналь характеризуется низким сродством к опсину, и спустя короткое время активированный родопсин диссоциирует на опсин и полностью транс-ретиналь. Специальная ретиналь-изомераза катализирует превращение транс-ретиналя в его цис-форму, после чего происходит самопроизвольная ассоциация цис-ретиналя с опсином, обусловленная высоким сродством этих структурных частей друг к другу, и снова образуется родопсин. Все перечисленные события циклически повторяются и известны под названием зрительный цикл (рис. 13.9).
Для понимания механизма генерирования нервного импульса в ходе каскадных событий, вызванных изомеризацией ретиналя под действием
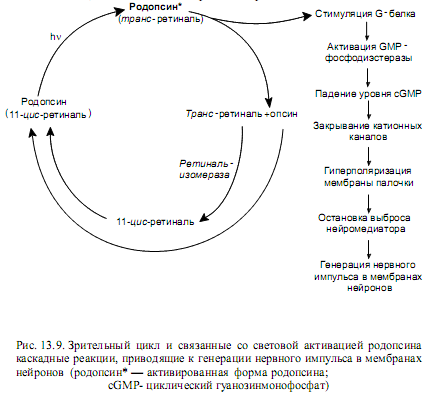
света, следует учитывать некоторые особенности функционирования светочувствительных клеток. В мембране палочки находятся катионные насосы, которые постоянно выкачивают ионы Na+ и Ca2+ из клетки, создавая на ней ионный градиент. В темноте внутрь палочек постоянно течет поток ионов натрия и кальция, которые пользуются cGMP-зависимыми каналами для возвращения в клетку согласно закономерностям облегченной диффузии. Эти каналы остаются открытыми при связывании с ними циклического гуанозинмонофосфата (cGMP).
При освещении происходят следующие события. Активный родопсин, в составе которого цис-ретиналь подвергнулся фотохимическому превращению в полностью транс-ретиналь, связывается с G-белком. При этом в составе G-белка GDP обменивается на GTP и белок диссоциирует на субъединицы, одна из которых представляет собой активную GTP-a-субъединицу. Эта структура активирует фермент сGMP-фосфодиэстеразу, которая катализирует гидролиз циклического гуанозинмонофосфата. Уровень сGMP быстро понижается, что приводит к перекрыванию катионных каналов. В результате концентрация ионов Na+ и Ca2+ на внутренней поверхности мембраны палочки резко падает, поскольку продолжают работать катионные насосы: происходит гиперполяризация клетки. Гиперполяризация замедляет высвобождение из палочек возбуждающего нейромедиатора (глутамата), и в ответ на это опосредованным образом в аксонах зрительного нерва возникает потенциал действия (глава 4).
Активная GTP-a-субъединица G-белка существует очень непродолжительное время и инактивируется за счет гидролиза GTP. Образуется свободная a-субъединица, ассоциирующая с остальными субъединицами с образованием G-белка, способного снова перейти в активную форму за счет связывания с активным родопсином.
Бактериородопсин. Белок, похожий по структуре на родопсин глаза (бактериородопсин), обнаружен в клетках некоторых архебактерий, где он тоже используется для фоторецепции. Высокоспециализированная в физиологическом отношении группа галобактерий (Halobacterium, Halococcus, Natrococcus, Natrobacterium) содержит необычные пурпурные мембраны, окрашенные в ярко оранжевые — ярко красные тона за счет содержания в них бактериородопсина. Эти бактерии уникальны тем, что способны за счет поглощения энергии света генерировать на мембране протонный градиент, который используется в качестве движущей силы при синтезе АТР. Другой отличительной особенностью галобактерий является способность развиваться в концентрированных растворах солей (галофилия).
Бактериородопсин представляет собой интегральный белок пурпурной мембраны, в которой он формирует полый цилиндр. Хромофором бактериородопсина служит ретиналь. В темноте ретиналь находится в полностью транс-форме и его альдиминная группа (=N+H-) протонирована (рис. 13.8). При освещении ретиналь перегруппировывается в 13-цис-форму, а альдиминная группа отдает протон, который через канал выводится на наружную поверхность мембраны. Так на мембране создается протонный градиент. Закономерности синтеза АТР за счет энергии протонного градиента такие же, как при окислительном фосфорилировании. Таким образом, бактериородопсин в пурпурных мембранах выполняет роль протонного насоса, приводимого в действие светом.
Энергия, запасенная в ходе такого необычного способа «фотосинтеза», дополняет энергию, которую галобактерии запасают в ходе дыхания.
Биолюминесценция
Под биолюминесценцией понимают способность живых организмов испускать видимый свет. В основе данного явления лежит ферментативное аэробное окисление веществ особого семейства, называемых люциферинами. Катализирующие этот процесс ферменты называют люциферазами. Энергия, выделяющаяся в процессе окисления люциферинов, превращается в энергию электронного возбуждения молекул, способных испускать ее в виде фотонов. Свечение может иметь самые разные тона: от голубого до красного.
К биолюминесценции способны многие организмы: бактерии, грибы, простейшие, моллюски, насекомые (светляки), кишечнополостные животные, ракообразные, рыбы и др. Люциферины этих организмов сильно различаются по структуре и свойствам. Большинство из них испускают свет при окислении, взаимодействуя с О2. Однако некоторые люциферины, например такие, как фотобелок медуз, активируются ионами кальция.
У светящихся бактерий роль люциферина выполняет FMNH2. При его окислении в присутствии альдегида с длинной цепью (не менее 8 атомов углерода) происходит одновременное окисление альдегида в карбоновую кислоту и люциферина в FMN:
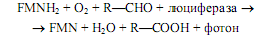
Эта реакция протекает, видимо, через стадию образования пероксида флавинмононуклеотида, а свечение характеризуется длиной волны ~490 нм.
Светящиеся организмы могут использовать явление биолюминесценции для опознавания особей своего вида, приманки добычи, в качестве брачных сигналов, отпугивания хищников и отвлечения их внимания, для «высвечивания» жертвы и т. д. Менее понятна роль биолюминесценции для низкоорганизованных организмов, например бактерий.
Существует точка зрения, согласно которой биолюминесценция возникла на стадии перехода от анаэробных форм жизни к аэробным как защитная реакция по отношению к мощному окислителю — молеку-лярному кислороду.
Дата добавления: 2016-05-30; просмотров: 3100;











