Причины и факторы риска
Фетоплацентарная недостаточность может развиваться под влиянием различных причин. Нарушения формирования и функции плаценты могут быть обусловлены заболеваниями сердца и сосудистой системы беременной (пороки сердца, недостаточность кровообращения, артериальная гипертензия и гипотензия), патологией почек, печени, легких, крови, хронической инфекцией, заболеваниями нейроэндокринной системы (сахарный диабет, гипо- и гиперфункция щитовидной железы, патология гипоталамуса и надпочечников) и целым рядом других патологических состояний.
ФПН при анемии обусловлена снижением уровня железа как в материнской крови, так и в самой плаценте, что приводит к угнетению активности дыхательных ферментов и транспорта железа к плоду.
При сахарном диабете нарушается метаболизм, выявляются гормональные расстройства и изменения иммунного статуса. Склеротическое поражение сосудов приводит к уменьшению притока артериальной крови к плаценте. На фоне данной патологии ФПН характеризуется замедленным или преждевременным созреванием плаценты с увеличением или уменьшением ее массы.
Важную роль в развитии ФПН играют различные инфекционные заболевания, особенно протекающие в острой форме или обостряющиеся во время беременности. Плацента может быть поражена бактериями, вирусами, простейшими и другими возбудителями инфекции. Наряду со специфическими воспалительными изменениями в плаценте отмечаются неспецифические реакции, характер которых зависит от времени и пути инфицирования.
Инфекционное поражение в I триместре нередко сопровождается прерыванием беременности. Инфицирование в более поздние сроки может быть ограничено локальными изменениями, которые зависят от характера возбудителя и пути его распространения.
Немаловажное значение в формировании ФПН играет патология матки: эндометриоз, гипоплазия миометрия, пороки развития матки (седловидная, двурогая).
Фактором риска ФПН следует считать миому матки. Однако риск ФПН у беременных с миомой матки различен. К группе с высоким риском относят первородящих в возрасте 36 лет и старше с преимущественно межмышечным расположением миоматозных узлов больших размеров, особенно при локализации плаценты в области расположения опухоли. При центрипетальном росте миомы, подслизистой и шеечной локализации узлов, а также при нарушении питания опухоли вероятность возникновения ФПН и нарушения развития плода приближается к 85%.
Группу с низким риском ФПН составляют молодые женщины до 30 лет без тяжелых экстрагенитальных заболеваний, с небольшими миоматозными узлами преимущественно подбрюшинного расположения в дне и теле матки.
Среди осложнений беременности, наиболее часто сопутствующих ФПН, ведущее место занимает гестоз, что обусловлено известными патогенетическими механизмами и морфофункциональными изменениями в системе мать — плацента — плод, которые имеют место при данной патологии. Степень выраженности ФПН соответственно зависит от тяжести и длительности течения гестоза.
Угрозу прерывания беременности следует одновременно рассматривать и как причину, и как следствие ФПН. В связи с различной этиологией ФПН при угрозе прерывания беременности патогенез этого осложнения имеет различные варианты, а прогноз для плода зависит от степени развития защитно-приспособительных реакций.
При низком расположении или предлежании плаценты васкуляризация субплацентарной зоны снижена. Более тонкая стенка нижнего сегмента матки не обеспечивает необходимых условий для достаточной васкуляризации плацентарного ложа и его нормального функционирования. Относительно часто при данной патологии происходит отслойка плаценты, сопровождающаяся кровопотерей.
Многоплодная беременность представляет естественную модель ФПНв результате неадекватного обеспечения потребностей двух и более плодов.
В основе ФПН при изосерологической несовместимости крови матери и плода чаще всего лежат процессы нарушения созревания плаценты. У плода развиваются анемия и гипоксия, возникает задержка развития из-за нарушений процессов синтеза белка и снижения активности ферментов.
Увеличение частоты осложнений течения беременности при наличии рубца на матке определяется рядом факторов. Дистрофические изменения, происходящие в области рубца, оказывают влияние на иннервацию матки и приводят к патологической импульсации, что в свою очередь нарушает трофику и моторику передней стенки матки. Трофические изменения передней стенки матки нередко приводят к нарушению маточно-плацентарного кровообращения, особенно при локализации плаценты на передней стенке матки. Этим также объясняется увеличение частоты преждевременной отслойки плаценты, а также вероятности преждевременного прерывания беременности. Локализация плаценты на передней стенке матки резко ухудшает прогноз беременности, касающийся как состоятельности рубца, так и развития плода.
Функциональное состояние плаценты во многом обусловлено степенью ее развития в соответствии с гестационным сроком и сохранностью защитно-приспособительных механизмов. Соответствие зрелости плаценты гестационному сроку является одним из наиболее важных условий обеспечения адекватного развития плода и его защиты.
Несомненно, что поздний возраст беременной, отягощенный анамнез (аборты, воспалительные заболевания), вредные привычки, воздействие неблагоприятных факторов окружающей среды, плохое питание, социальная незащищенность и бытовая неустроенность также способствуют осложненному формированию плаценты и нарушению ее функции.
К факторам риска развития ФПН относят:
• возраст младше 17 лет и старше 35 лет;
• неблагоприятные социально-бытовые условия;
• токсическое и радиационное воздействие внешней среды;
• вредные пристрастия (алкоголь, курение, наркотики);
• инфекционные заболевания;
• экстрагенитальные заболевания (болезни сердечно-сосудистой системы, органов дыхания, печени, почек, крови, нервной системы, эндокринных органов, иммунной системы);
• гинекологические заболевания (воспалительной этиологии с нарушением нейроэндокринной регуляции менструальной функции, сопровождающиеся новообразованиями);
• неблагоприятный акушерско-гинекологический анамнез (бесплодие, привычное невынашивание, самопроизвольные и искусственные аборты, преждевременные роды, перенашивание беременности, мертворождение, полостные операции на органах малого таза, рубец на матке, выскабливание стенок матки, осложненное течение предыдущей беременности и родов);
• осложнения настоящей беременности (ранний токсикоз, многоплодная беременность, тазовое предлежание плода, аномальное расположение плаценты, гестоз, изосенсибилизация крови матери и плода).
Перечисленные факторы прежде всего приводят к нарушениям маточно-плацентарного, а далее и фетоплацентарного кровообращения. В силу происходящих изменений развиваются необратимые морфологические процессы и нарушаются основные функции плаценты.
Клиническая практика и результаты научных исследований свидетельствуют о многофакторной природе ФПН.В этой связи практически невозможно выделить какой-либо единственный фактор развития данного осложнения. Перечисленные патологические состояния не в одинаковой мере оказывают влияние на развитие ФПН. Чаще всего в развитии этой патологии участвуют несколько этиологических факторов, один из которых может быть ведущим.
Патогенез
Знание основных звеньев патогенеза ФПНявляется фундаментом правильной диагностики, лечения и профилактики этого осложнения беременности.
В развитии ФПНможно выделить несколько взаимосвязанных патогенетических факторов:
• недостаточность инвазии цитотрофобласта;
• патологическое изменение маточно-плацентарного кровообращения;
• нарушение фетоплацентарного кровотока;
• незрелость ворсинчатого дерева;
• снижение защитно-приспособительных реакций;
• поражение плацентарного барьера.
Морфогенез плаценты во многом зависит от развития МПК. Согласно данным морфологических исследований, с 16—18-го дня наблюдается процесс инвазии интерстициального цитотрофобласта. На 5—6-й неделе процессы инвазии приобретают наиболее интенсивный характер с появлением клеток внутрисосудистого цитотрофобласта в просвете эндометриальных сегментов спиральных артерий. Первая волна инвазии цитотрофобласта способствует расширению и вскрытию спиральных артерий в межворсинчатое пространство, что обеспечивает начало и прирост МПК. К исходу 10-й недели на всей площади decidua basalis образуется система зияющих маточно-плацентарных артерий с широким просветом и постоянным кровотоком. Первая волна инвазии цитотрофобласта затухает в течение 11—14 нед.
На 16—18-й неделе беременности начинается вторая волна инвазии цитотрофобласта за счет миграции внутрисосудистого цитотрофобласта в глубь стенок миометральных сегментов спиральных артерий, что сопровождается разрушением эластомышечных компонентов сосудов и замещением их фибриноидом (рис. 10.1). В это же время наблюдается проникновение интерстициального цитотрофобласта в миометрий для активации изменений в сосудистой стенке со стороны адвентициальной оболочки.
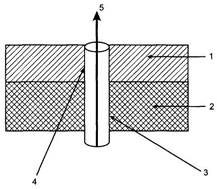
Рис. 10.1. Изменения в спиральных артериях в процессе инвазии цитотрофобласта.
Эндометрий; 2 — миометрий; 3 — миометральный сегмент спиральной артерии; 4 — эндометриальный сегмент спиральной артерии; 5 — кровоток по спиральной артерии в межворсинчатое пространство.
В результате деструкции мышечных элементов эндо- и миометральных сегментов спиральных артерий происходит значительное расширение их просвета и теряется способность отвечать на воздействие вазопрессорных факторов, что обеспечивает дальнейший прирост МПК.
Предполагается, что управляющую роль в этом сложном процессе выполняют децидуальные клетки, которые продуцируют местно-действующие регуляторы пролиферации и инвазии цитотрофобласта.
Происходящие изменения в стенках спиральных артерий следует рассматривать как адаптационный физиологический процесс, направленный на обеспечение непрерывного адекватного притока крови к межворсинчатому пространству.
Если к исходу I триместра беременности неполностью реализуется первая волна инвазии цитотрофобласта (сохраняются эластомышечные элементы эндометриальных сегментов спиральных артерий), то это приводит к значительному снижению объема притекающей материнской крови и задержке начала МПК. Образуются зоны некроза в decidua basalis, которые приводят к отслойке плаценты и смерти эмбриона.
Результаты многочисленных исследований плацентарного ложа во второй половине беременности при гестозе, гипертензии беременных, задержке развития плода свидетельствуют о том, что этим патологическим состояниям часто предшествует недостаточность второй волны инвазии цитотрофобласта в миометральные сегменты спиральных артерий. Сосуды сохраняют эндотелий, среднюю оболочку и эластические мембраны. Узкий просвет спиральных артерий, их резистентность и чувствительность к сосудодвигательным раздражителям препятствует нормальному кровотоку, не обеспечивает адекватного прироста МПК, приводит к уменьшению кровоснабжения плаценты и ишемии ворсин.
Возможно, артериальная гипертензия, связанная с беременностью, развивается как компенсаторная реакция, которая направлена на усиление притока крови в межворсинчатое пространство в ответ на недостаточность второй волны инвазии цитотрофобласта.
Нарушение кровотока в спиральных артериях сопровождается также геморрагическими нарушениями и в межворсинчатом пространстве. Патология спиральных артерий может привести как к преждевременной отслойке плаценты, так и к ее острому геморрагическому инфаркту.
Одним из ведущих факторов патогенеза ФПН является нарушение маточно-плацентарного кровообращения, в основе которого заложены морфофункциональные изменения сосудистой системы и отдельных ее компонентов, причем особое значение отведено расстройствам в бассейне спиральных артерий и в межворсинчатом пространстве.
К 10—12-й неделе физиологически протекающей беременности заканчивается период плацентации, который характеризуется васкуляризацией ворсин и превращением вторичных ворсин в третичные. Основной структурной единицей плаценты становится котиледон, который образован стволовой ворсиной с разветвлениями, содержащими сосуды плода. Центральная часть котиледона образует полость, которая окружена ворсинами второго и третьего порядка. В зрелой плаценте насчитывается от 30 до 50.
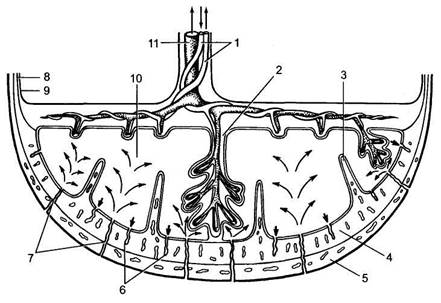
Рис. 10.2. Структура плаценты и маточно-плацентарного кровообращения.
1 — артерии пуповины; 2 — стволовая ворсина; 3 — децидуальная перегородка; 4 — деци-дуальный слой;
5 — миометрий; 6 — вены; 7 — спиральные артерии; 8 — хорион; 9 — амнион; 10 — межворсинчатое пространство;
11 — вена пуповины.
Межворсинчатое пространство с плодовой стороны образовано хориальной пластинкой и прикрепленными к ней ворсинами, а с материнской стороны оно ограничено базальной пластинкой, децидуальной оболочкой и отходящими от нее септами (рис. 10.2).
Спиральные артерии, которые являются конечными ветвями маточной и яичниковой артерий, питающих матку, открываются в межворсинчатое пространство 120—150 устьями. В результате гестационной перестройки спиральных артерий обеспечивается постоянный приток материнской крови, богатой кислородом, в межворсинчатое пространство.
За счет разницы давления, которое выше в материнском артериальном русле по сравнению с межворсинчатым пространством, кровь, насыщенная кислородом, из устьев спиральных артерий направляется через центр котиледона к ворсинам, достигает хориальной пластинки и по разделительным септам возвращается в материнский кровоток через венозные устья.
Густая сеть терминальных и промежуточных ворсин образует капиллярное звено МПК, где через плацентарный барьер происходит диффузия газов и обмен питательных веществ между кровью матери и плода.
Отток крови из межворсинчатого пространства происходит через венозные устья, большинство из которых расположено вблизи септ, разделяющих котиледоны. Венозные устья и коллекторы не подвергаются гестационной перестройке, сохраняют эндотелиальную выстилку и отдельные гладкомышечные клетки.
Вены плацентарного ложа из верхней части тела матки переходят в гроздевидное сплетение, а из нижней части — в систему маточной вены, образуя многочисленные анастомозы.
На фоне сохранения мышечных элементов в стенках сосудов субплацентарной зоны, полной или частичной обтурации сосудов из-за атеросклеротических изменений, расстройства сосудисто-тромбоцитарного звена, тромбоза или микроэмболии происходят нарушения в сосудистой системе матки, межворсинчатом пространстве, сосудах плаценты и пуповины.
Следует принимать во внимание, что система кровоснабжения матки является лишь частью общей системы кровообращения организма женщины. Исходя из этого, патология МПК может расцениваться как одно из регионарных проявлений дезадаптации материнского организма и регуляторных механизмов сердечно-сосудистой системы (вегетативная нервная система, система ренин — ангиотензин, серотонин, брадикинин, катехоламины, простагландины и др.), которые изменяют тонус сосудов и реологические свойства крови.
Нарушение кровотока в отдельных сосудах не всегда приводит к значительному уменьшению кровоснабжения плаценты, так как оно компенсируется за счет коллатерального кровотока. Если коллатеральное кровообращение выражено недостаточно, то развиваются нарушения микроциркуляции, ишемия и дегенерация участков плаценты.
Нарушение МПК характеризуется следующими важнейшими факторами:
• снижением притока к межворсинчатому пространству;
• затруднением оттока из межворсинчатого пространства;
• изменениями реологических и коагуляционных свойств крови матери и плода;
• расстройством капиллярного кровотока в ворсинах хориона.
Безусловно, что наиболее важной, но не единственной причиной снижения притока крови в межворсинчатое пространство является отсутствие гестационной перестройки миометральных сегментов спиральных артерий в результате недостаточности второй волны инвазии цитотрофобласта.
Определенную роль в уменьшении интенсивности кровотока в маточно-плацентарных сосудах играют гиповолемия (возникающая у беременных при гестозе), артериальная гипотензия или низкая локализация плаценты (нижний сегмент, предлежание плаценты).
Пороки сердца у беременных и снижение сократительной активности миокарда также приводят к уменьшению притока крови к матке. Анемия беременных способствует редукции газообмена и оксигенации крови плода.
Снижение МПК оказывает серьезное влияние на формирование ФПН всвязи с тем что уровень газообмена обусловлен в большей степени скоростью кровотока, чем диффузионными свойствами плаценты. Следовательно, замедление кровотока в спиральных артериях и межворсинчатом пространстве неизменно приводит к снижению газообмена между кровью матери и плода.
Нарушение оттока крови из межворсинчатого пространства отмечается при сердечно-сосудистых и легочных заболеваниях, при гипертонусе и повышенной сократительной активности матки. Во время сокращений матки значительно увеличивается давление в миометрии, амниотической полости и в межворсинчатом пространстве. При этом в маточно-плацентарных артериях давление крови существенно не изменяется, а венозный отток практически прекращается. На этом фоне происходит дальнейшее увеличение давления и существенное замедление циркуляции крови в межворсинчатом пространстве. Последующее возрастание давления в межворсинчатом пространстве до уровня, превышающего системное артериальное давление, служит препятствием для поступления крови по спиральным артериям (ишемия плаценты).
Таким образом, нарушение оттока и притока крови вызывает резкое снижение гемоциркуляции в межворсинчатом пространстве и уменьшение газообмена между кровью матери и плода.
Снижение скорости кровотока в межворсинчатом пространстве, особенно в сочетании с нарушением синтеза и баланса простагландинов Е2 и F2α, простациклина и тромбоксана А2, приводит к тромбообразованию, гиперкоагуляции, повышению вязкости крови, отложению фибрина, снижению микроциркуляции и развитию нодулярной ишемии.
Существенная роль в развитии ФПН отведена нарушению фетоплацентарного кровотока. Артериальная система ФПК, несущая венозную кровь от плода к плаценте, представлена двумя артериями пуповины, которые берут начало от общих подвздошных артерий плода. Конечными ветвями пуповинных артерий являются артерии и артериолы ворсин I, II и III порядка. Стенка артерий пуповины включает в себя два мышечных слоя: - наружный с циркулярным расположением мышечных пучков и внутренний с продольным их направлением.
Продолжением артериол являются многочисленные извитые капилляры в составе терминальных ворсин. На верхушках терминальных ворсин капилляры расширяются, образуя синусоиды, которые располагаются под истонченным синцитиотрофобластом и формируют плацентарный барьер.
От капиллярных петель на уровне промежуточных дифференцированных ворсин берет начало венозное звено ФПК. Далее от оснований опорных ворсин венозные сосуды (несут насыщенную кислородом кровь) направляются в толщу хориальной пластинки и сливаются в единую вену пуповины, представляющую собой мощный сосуд эластомышечного типа, переходящий в венозный проток в области печени плода.
Кровоток в пуповине и плаценте осуществляется за счет сократительной деятельности сердца плода, которое обладает ограниченными возможностями увеличения сердечного выброса. Важным фактором кровотока является также наличие гладкомышечных слоев в стенках артерий пуповины, выполняющих роль «дополнительного», или «периферического сердца».
Одним из механизмов возврата крови из плаценты к плоду является гравитационная разница в позиции плаценты и плода (плацента находится выше или на одном уровне с сердцем плода), которая способствует оттоку крови по пуповине.
Кроме того, ритмичная пульсация артерий пуповины, обвивающих вену, передается на ее стенки через эластичный вартонов студень, что также способствует оттоку крови. Вена пуповины обладает собственной сократительной способностью, так как строение ее мышечной оболочки и внутренней эластичной мембраны напоминает структуру артерий эластомышечного типа у взрослого человека.
Автономная регуляция ФПКобеспечивается сосудорасширяющим и сосудосуживающим влиянием местно-гуморальных факторов, вырабатываемых в плаценте или в организме плода. Сосудорасширяющее влияние оказывают простациклин и эндотелиальный натрийуретический пептид, которые вырабатываются эндотелиальными клетками. Роль вазоконстрикторов выполняют тромбоксан А2, ангиотензин II и эндотелии I.
При доминирующем нарушении ФПК отмечается снижение кровообращения в артериях пуповины, хориальной пластинки и опорных ворсин, что сопровождается картиной облитерационной ангиопатии. В большинстве наблюдений выявлены нормальные гестационные изменения спиральных артерий. Более чем в половине наблюдений имеет место патологическая незрелость ворсин. В результате воздействия местных сосудосуживающих факторов наблюдается сужение просвета пупочных артерий. Развивается облитерация артерий и артериол в опорных ворсинах и снижается капиллярный кровоток. В результате гипоксии и активизации ворсинчатого цитотрофобласта дистально расположенные ворсины полностью замуровываются фибриноидом, что является следствием первичного прекращения кровообращения в их капиллярах. Выключение замурованных фибриноидом ворсин из межворсинчатого кровотока приводит к нарушению газообмена, расстройству функции плаценты и развитию ФПН.
Одной из важных причин расстройства функции плаценты и развития ФПН является незрелость ворсинчатого дерева, которая проявляется изменениями всех ее структурных единиц.
Выделяют несколько вариантов патологической и относительной незрелости плаценты.
▲ Вариант незрелых мезенхимальных ворсин представляет собой самую раннюю форму незрелости плаценты, которая развивается в результате антенатальных повреждений в стадии вторичных или мезенхимальных ворсин. Остановка развития ворсин характеризуется отсутствием дальнейшей дифференцировки мезенхимы в направлении аутохтонного ангиогенеза и других компонентов стромы.
▲ Вариант эмбриональных ворсин обусловлен персистенцией регрессирующих ворсин. Ранняя патологическая незрелость формируется в результате антенатального повреждения в промежутке от 21—22 дней до 7—8 нед.
При этом в ворсинах из капилляров не образуются артериолы и венулы, что может быть вызвано несоответствием начавшегося ангиогенеза в ворсинах с темпами формирования кровеносной системы эмбриона или слияния сосудов развивающейся пуповины с ворсинчатым деревом. Негативное влияние может также проявиться вследствие несостоятельности первой волны инвазии цитотрофобласта, которая имеет место в это же время.
В составе плаценты встречается 50—60% эмбриональных ворсин при раннем токсикозе, изосерологической несовместимости крови матери и плода, сахарном диабете, инфекциях (токсоплазмоз, краснуха, сифилис).
▲ Вариант промежуточных незрелых ворсин характеризуется тем, что при антенатальном повреждении в промежутке от 8—9 до 16—18 нед происходит персистенция промежуточных незрелых ворсин, сохраняющих морфофункциональную активность. Основным патогенетическим механизмом развития этого варианта незрелости плаценты является недостаточность второй волны инвазии цитотрофобласта в миометральные сегменты спиральных артерий. Отсутствие дальнейшего роста объема МПК приводит к тому, что ворсинчатое дерево к середине беременности не способно адекватно реализовать свои диффузионные возможности.
Вариант промежуточных незрелых ворсин встречается при раннем антенатальном инфицировании, сахарном диабете, нефритах и другой соматической патологии у беременной.
▲ Вариант промежуточных дифференцированных ворсин проявляется персистенцией ворсинчатого дерева без образования терминальных ворсин в результате антенатального повреждения на 21—32-й неделе, когда в норме происходит интенсивный рост промежуточных ветвей. Морфологические особенности строения промежуточных дифференцированных ворсин приводят к уменьшению диффузионной поверхности ворсинчатого дерева, площади гормонобразующего синцитиотрофобласта и объема межворсинчатого пространства. Чаще всего на этом фоне отмечается ЗВУР плода.
▲ Вариант хаотичных склерозированных ворсин формируется в результате антенатальных повреждений на 25—30-й неделе и характеризуется нарушением формирования мелких ворсин с преобладанием стромального компонента, отставанием развития капиллярного русла и эпителиального покрова. Отмечается беспорядочное ветвление мелких ворсин с единичными узкими капиллярами, которые по своему строению не соответствуют типичным терминальным ветвям.
Вариант хаотичных склерозированных ворсин часто встречается при тяжелой форме гестоза, артериальной гипертензии, многоплодной беременности.
Перечисленные варианты патологической незрелости плаценты чаще всего приводят к смерти плода или к задержке его внутриутробного развития.
Выделяют также две формы относительной незрелости плаценты.
▲ Преждевременное созревание плаценты обусловлено появлением преобладающего числа типичных терминальных ворсин ранее 32— 33 нед. Большинство из этих ворсин не соответствует специализированному типу терминальных ворсин, которые образуются в течение последнего месяца беременности.
▲ Диссоциированное развитие котиледонов характеризуется наличием зон промежуточных дифференцированных или незрелых ворсин, а также отдельных групп эмбриональных ворсин наряду с преобладанием нормальных терминальных ворсин, соответствующих гестационному сроку.
Неравномерное созревание котиледонов часто наблюдается при гестозе. Следовательно, характер процессов созревания плаценты тесно взаимосвязан с различной акушерской патологией.
В патогенезе ФПН существенная роль отводится снижению активности защитно-приспособительных реакций в системе мать — плацента — плод в ответ на патологический процесс.
При физиологически протекающей беременности эти реакции направлены на оптимальное поддержание функции фетоплацентарного комплекса. Степень выраженности ФПН во многом определяется сохранностью защитно-приспособительных реакций и нормальной структурой плаценты.
Нормальный газообмен между организмом матери и плода обеспечивается адекватным состоянием МПК и ФПК.
Примером компенсаторной реакции со стороны материнского организма является увеличение минутного объема сердца и ОЦК, а также снижение сосудистого сопротивления в маточных артериях.
Даже при нормально протекающей беременности количество поступающего кислорода в организм плода ниже, чем у взрослого человека. Этот дефицит успешно компенсируется различными приспособительными механизмами, что обеспечивает нормальное развитие плода.
Одним из таких приспособительных механизмов является высокий сердечный выброс у плода (в 3—4 раза больше, чем у взрослого человека из расчета на 1 кг массы). Уровень гемоглобина в крови матери составляет около 120 г/л, а в крови плода около 150 г/л. Каждый грамм гемоглобина соединяется с 1,34 мл кислорода. Такое увеличение способности крови к переносу кислорода наряду с повышением сродства крови плода к кислороду содействует оптимизации его перехода из материнского в плодовый кровоток. Наличие анатомических плодовых шунтов (венозный проток, артериальный проток, овальное окно) способствует тому, что почти во все органы плода поступает смешанная кровь. В этом случае падение парциального давления кислорода при гипоксии происходит более медленно.
К компенсаторным реакциям, обеспечивающим устойчивость плода к гипоксии, относят также низкий уровень его метаболизма и высокую активность гликолиза.
Компенсаторные реакции со стороны плаценты проявляются расширением просвета плодных сосудов. За счет увеличения количества терминальных ворсин повышается общая обменная площадь плаценты для обеспечения достаточного насыщения крови плода кислородом.
Важнейшим компенсаторным механизмом второй половины беременности является образование синцитиокапиллярных мембран, через которые осуществляется газообмен и транспорт питательных веществ.
При недостаточном газообмене в качестве компенсаторной реакции повышается активность анаэробных процессов метаболизма, направленная на нормализацию нарушений кислородного обмена между матерью и плодом, снижается потребление кислорода плацентой и тканями плода.
Оптимизация МПК обеспечивается за счет формирования миометральных и плацентарных артериовенозных шунтов.
Под действием повреждающих этиологических факторов, способствующих развитию ФПН, перечисленные компенсаторные реакции могут носить неполноценный характер. Резерв проявления защитно-приспособительных реакций имеет определенный предел, после которого наступают необратимые патологические сдвиги в фетоплацентарном комплексе, приводящие к декомпенсированной форме ФПН, включая смерть плода.
Поражение плацентарного барьера под влиянием патологических факторов также относят к одному из патогенетических механизмов развития ФПН.
Плацентарный барьер, состоящий из эпителиального покрова ворсин, общего базального слоя синцититрофобласта и эндотелиоцита прилежащего капилляра, а также цитоплазматического слоя эндотелиоцита, осуществляет функциональное взаимодействие между МПК и ФПК (рис. 10.3). Строение плацентарного барьера обеспечивает интенсивный газообмен и транспорт питательных веществ между материнским и плодовым кровотоком.
Функционирует несколько путей транспорта веществ через плацентарный барьер.
▲ Диффузия обеспечивает перемещение газов, липидов, жирорастворимых витаминов и некоторых лекарств через мембраны из области их высокой концентрации в область более низкой за счет движения молекул.
▲ Облегченная диффузия осуществляет транспорт углеводов и аминокислот. Особые молекулы-носители захватывают эти вещества из плазмы крови матери (область высокой концентрации) и переносят их через плацентарный барьер в плодовый кровоток (область низкой концентрации).
▲ Активный транспорт позволяет переносить вещества в противоположном концентрационному градиенту направлении. Такой вид транспорта реализуется с потреблением энергии, так как переносимые этим путем аминокислоты, белки, витамины и микроэлементы (кальций, железо и др.) предварительно подвергаются в цитоплазме синцитиотрофобласта и эндотелиоцита определенным химическим реакциям и перемещаются через плацентарный барьер с помощью молекул-носителей.
▲ Пиноцитоз способствует продвижению через плацентарный барьер белков плазмы, иммуноглобулинов и гормонов. Механизм пиноцитоза заключается в том, что образующиеся мембранные инвагинации захватывают переносимые вещества и трансформируются в пузырьки, которые перемещаются через все слои плацентарного барьера и вскрываются на его противоположной стороне.
▲ Дефекты плацентарной мембраны позволяют перемещаться через плацентарный барьер материнским и плодовым клеткам крови, а также возбудителям некоторых инфекций.
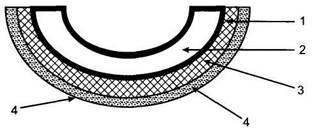
Рис. 10.3. Строение плацентарного барьера.
1 — эндотелий капилляров терминальных ворсин; 2 — капилляр ворсины; 3 — синцитиотрофобласт; 4 — эпителиальный покров ворсин.
▲ Объемный перенос веществ осуществляется за счет гидростатического или осмотического градиента. Таким способом перемещается вода и растворенные электролиты.
На регуляцию проницаемости плацентарного барьера оказывают влияние ряд ферментов. Проницаемость клеточных мембран обусловлена также равновесием между перекисным окислением липидов (ПОЛ) и системой антиоксидантной защиты в организме матери и плода. При развитии ФПН в результате нарушения обмена углеводов и липидов усиливается ПОЛ на фоне снижения антиоксидантной активности, что является одной из важных причин повреждения клеточных мембран плаценты и нарушения их проницаемости.
В результате действия повреждающих факторов в I—II триместре развитие ФПН может быть обусловлено преобладающим поражением плацентарного барьера.
При этом наблюдаются наиболее тяжелые варианты незрелости ворсин с прогрессирующим склерозом стромы. Отмечается выраженное снижение кровотока в капиллярном русле плаценты (нарушение ФПК) при относительной сохранности МПК, что приводит к развитию местной гипоксии. Более чем в половине наблюдений отмечена нормальная гестационная перестройка спиральных артерий. Отличительным гистологическим признаком данного варианта развития ФПН является атрофия синцититрофобласта и выраженное утолщение плацентарного барьера, что приводит к нарушению его транспортной функции.
Ведущая роль тех или иных патогенетических механизмов в развитии ФПН во многом обусловлена ее этиологическими факторами.
При гестозе и гипертонической болезни на первый план выступают изменения МПК и микроциркуляции. Иммунологический конфликт изначально проявляется нарушением проницаемости клеточных мембран, и лишь вторично развиваются циркуляторные и другие расстройства.
При беременности, осложненной гормональными расстройствами, первичным звеном ФПН является снижение васкуляризации хориона.
В результате воздействия повреждающих факторов и реализации патогенетических механизмов, приводящих к ФПН, закономерно развивается гипоксия плода.
Чаще всего (по механизму развития) наблюдается артериально-гипоксемическая и смешанная форма гипоксии вследствие снижения содержания кислорода в крови матери, уменьшения МПК, нарушения транспортной функции плацентарного барьера, изменения реологических свойств крови, анемии, аномалий развития плода и также целого ряда других причин.
На начальных этапах развития гипоксии у плода активизируются вазопрессорные факторы, повышается тонус периферических сосудов, отмечается тахикардия, увеличивается частота дыхательных движений, повышается двигательная активность, возрастает минутный объем сердца.
Дальнейшее прогрессирование гипоксии приводит к смене тахикардии на брадикардию, появляется аритмия, уменьшается минутный объем сердца. Адаптационной реакцией на гипоксию является перераспределение крови в пользу мозга, сердца и надпочечников с одновременным уменьшением кровоснабжения остальных органов. Параллельно угнетается двигательная и дыхательная активность плода. Вследствие избыточного накопления в организме плода углекислого газа и развития метаболических нарушений у плода отмечаются:
• патологический ацидоз;
• гипергликемия;
• снижение окислительной и пластической роли глюкозы;
• истощение запасов гликогена и липидов;
• энергетическая недостаточность;
• нарушение гормональных механизмов регуляции;
• дисбаланс электролитов;
• задержка развития.
Характер и тяжесть по
Дата добавления: 2020-05-20; просмотров: 666;











