Решение типовых задач
Пример 1.
При сгорании 16 г магния выделилось 400,8 кДж. Определите энтальпию образования MgO(к.).
Решение.
Запишем термохимическое уравнение реакции:
Mg(к.) + 1/2 O2(г.) = MgO(к.), DНреак.= х кДж.
Из условия задачи следует, что при сгорании некоторого числа молей магния выделилось 400,8 кДж, поэтому, сначала находим количество вещества прореагировавшего магния:
ν = m/М = 16/24 = 0,66(6) моль.
Если при сгорании 0,66(6) моль магния выделяется 400,8 кДж, то при сгорании 1 моль магния выделяется х кДж (это и есть теплота образования MgO(к.)):
х = 1·(–400,8)/0,66(6) = – 601,2 кДж
Ответ: DНf(MgO) = – 601,2 кДж/моль.
Пример 2.
Найти тепловой эффект реакции
B2O3(к.) + 3 Mg(к.) = 2 B(к.) + 3 MgO(к.), DНреак = х кДж,
если энтальпии образования B2O3(к.) и MgO(к.) равны соответственно –1272,8 и –601,2 кДж/моль.
Решение:
Воспользуемся следствием из закона Гесса, которое гласит: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ:
DНх = 3·DНf(MgO) – DНf (B2O3) = –1803,6 – (– 1272,8) = –530,8 кДж/моль. Напомним, что стандартные теплоты образования простых веществ равны нулю.
Ответ: – 530,8 кДж/моль
Пример 3.
Определить стандартную энтальпию сгорания метана, если стандартные энтальпии образования CH4(г.), CO2(г.) и H2O(ж.) равны соответственно –74,8; –393,5 и –285,8 кДж/моль.
Решение:
Запишем термохимическое уравнение реакции:
CH4(г.) + 2 02(г.) = CO2(г.) + 2 H2O(ж.); DHºреакц. = ?
Используя первое следствие из закона Гесса, находим, что
DHºреакц. = 2 DHf (H2O) + DHf (CO2) – DHf (СН4);
DHºреакц = [2 (–285,8) + (–393,5)] – (–74,8) = –890,3 кДж/моль
Ответ: – 890,3 кДж/моль
Пример 4. Определите, как изменится энтропия при протекании химического процесса Na2O(т) + H2O(ж) = 2NaOH(т).
Решение:
В данном процессе при взаимодействии 1 моль кристаллического и 1 моль жидкого вещества образуется 2 моль кристаллического вещества. Следовательно, система переходит в состояние с меньшим беспорядком, и энтропия уменьшается (ΔS<0).
Пример 5.
Пользуясь данными справочника, определите, может ли при стандартной температуре самопроизвольно протекать реакция
Fe2O3(к.) + H2(г.) = 2 FeO(к.) + H2O(г.)?
Решение:
По справочнику находим, что DGобрFe2O3(к.) = –740,3 кДж/моль;
DGобрFeO(к.) = –244,3кДж/моль; DGобрH2O(г.) = –228,6 кДж/моль.
Тогда,
DGреакц = 2×DGобр (FeO(к.)) + DGобр.(H2O(г.)) – DGобр(Fe2O3(к.)) =
[2 (–244,3) + (–228,6)] – (–740,35) = –23,17 кДж
Так как DGреакц < 0, процесс может протекать самопроизвольно при стандартной температуре 298,15 К.
Пример 6. Пользуясь значениями 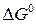 образования отдельных соединений, вычислить
образования отдельных соединений, вычислить 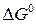 реакций:
реакций:
а) COCl2=CO+Cl2
б) SO2+NO2=SO3 (г)+NO
и определить, возможно ли их осуществление в стандартных условиях.
Решение:
а) 
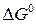 >0 и реакция в данных условиях неосуществима.
>0 и реакция в данных условиях неосуществима.
б) 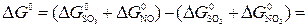
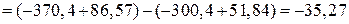 кДж.
кДж.
Итак, 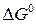 <0 , что свидетельствует о возможности осуществления реакции в стандартных условиях.
<0 , что свидетельствует о возможности осуществления реакции в стандартных условиях.
Пример 7. Установите, возможно ли при температурах 298 и1000 К восстановление оксида Fe(III) до свободного металла по уравнению
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г)
При стандартных состояниях.
Решение. В справочных таблицах найдем значения  298,
298,  298 для исходных веществ и продуктов реакции.
298 для исходных веществ и продуктов реакции.
| Вещество |  298, кДж/моль 298, кДж/моль
|  298,Дж/(моль∙К) 298,Дж/(моль∙К)
|
| Fe2O3(к) | -821,3 | 89,8 |
| H2(г) | 130,6 | |
| Fe(к) | 27,15 | |
| H2O(г) | -241,7 | 188,8 |
Рассчитаем стандартные энтальпию и энтропию реакции:
 = 3(-241,7) + 821,3 =96,2 кДж,
= 3(-241,7) + 821,3 =96,2 кДж,
 = (2 ∙ 27,15 + 3 ∙188,8) – (89,8 + 3 ∙ 130,6) = (54,3 + 566,4) – (89,8 + 391,8) = 139,1 Дж/К
= (2 ∙ 27,15 + 3 ∙188,8) – (89,8 + 3 ∙ 130,6) = (54,3 + 566,4) – (89,8 + 391,8) = 139,1 Дж/К
Энергия Гиббса химической реакции равна  , рассчитаем энергию Гиббса при 298 К:
, рассчитаем энергию Гиббса при 298 К:
 298 = 96,2 ∙ 103 – 298 ∙ 139,1 = 96,2 ∙ 103 – 41451 = + 54748 Дж = 54,75 кДж.
298 = 96,2 ∙ 103 – 298 ∙ 139,1 = 96,2 ∙ 103 – 41451 = + 54748 Дж = 54,75 кДж.
Для данного процесса при 298 К 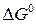 > 0, т.е. невозможно восстановление Fe2O3(к) водородом для получения свободного металла.
> 0, т.е. невозможно восстановление Fe2O3(к) водородом для получения свободного металла.
Рассчитаем энергию Гиббса реакции при 1000 К:
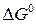 1000 = 96,2 ∙ 103 – 1000 · 139,1 = -42,9 ∙ 103 Дж = - 42,9 кДж.
1000 = 96,2 ∙ 103 – 1000 · 139,1 = -42,9 ∙ 103 Дж = - 42,9 кДж.
Для данного процесса при 1000 К 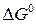 <0, т.е. возможно восстановление Fe2O3(к) водородом для получения свободного металла.
<0, т.е. возможно восстановление Fe2O3(к) водородом для получения свободного металла.
Дата добавления: 2020-03-21; просмотров: 709;











