ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Для нормальной функции почкам необходимы определенный резерв жидкости и определенный уровень ее осмолярности. При среднем АД ниже 70 мм рт.ст. клубочковая фильтрация прекращается. Гиповолемия, шок сопровождаются снижением почечного кровотока, а иногда и полным его прекращением, что ведет к нарушению выделительной функции почек. Если сниженный почечный кровоток сохраняется длительно, то, несмотря на нормализацию гемодинамики, развивается «шоковая почка».
Начальная фаза. Важнейшей мерой профилактики ОПН является своевременная и оптимальная терапия шока. Если шок продолжается, то функциональные нарушения переходят в ОПН с морфологическими нарушениями («шоковая почка»).
Во время лечения шока следует помнить о влиянии высокомолекулярных соединений (декстраны) на функцию почек. Не следует применять сосудосуживающие препараты, поскольку вазоконстрикция почечной области вызывает глубокую ишемию почек и тем самым способствует еще большему поражению почечных структур. Важно знать, что наряду с мероприятиями, направленными на восстановление гемодинамики, следует позаботиться о восстановлении диуреза.
Антистрессовая терапия (адекватное обезболивание, альфа-адреноблокаторы) способствует восстановлению мезентериального и почечного кровотока. При стойкой олигурии, диурезе до 30 мл/ч и ниже необходимы мочегонные средства.
Маннитол обеспечивает достаточный диурез при снижении среднего АД до 30 мм рт.ст. Почечный кровоток при назначении маннитола повышается. Осмотическое действие проявляется торможением абсорбции воды в канальцах и образованием гипотонического фильтрата. Маннитол показан как для профилактики, так и для лечения развившейся функциональной недостаточности почек. Для этого 10 % раствор препарата вводят внутривенно по методу титрования до получения необходимого эффекта (100 мл мочи в 1 ч).
Для диагностики фазыОПН применяют маннитоловую пробу. Предварительно должны быть устранены гиповолемия и дегидратация. 75— 100 мл 20 % маннитола вводят внутривенно в течение 5—15 мин. Если диурез увеличивается на 30—40 мл/ч, то диагностируется функциональная недостаточность почек, и лечение маннитолом можно продолжать (положительная маннитоловая проба). Суточная доза препарата не должна превышать 50—150 г. Если же на введение маннитола не наступило повышения выделения мочи на 30—40 мл/ч, то это указывает на олигоанурическую фазу ОПН, и дальнейшее применение препарата противопоказано из-за опасности сердечной недостаточности и развития острого отека легких.
В некоторых случаях эффект маннитола не проявляется из-за резисгентности к нему. В то же время назначение салуретиков (фуросемид, этакриновая кислота) может дать хороший результат. С целью профилактики фуросемид может быть назначен в дозе 40—120 мг внутривенно с интервалом 4—6 ч или в виде непрерывной инфузии в течение суток на изотоническом растворе хлорида натрия.
Если имеются противопоказания к пробе с маннитолом, используют пробу с фуросемидом. Вначале вводят 100—250 мг фуросемида. Если в течение 1 ч диурез не восстанавливается, то назначают вторую дозу фуросемида 1000 мг в 100 мл изотонического раствора хлорида натрия, которую вводят в течение 1 ч. Если диурез увеличился и достиг 40 мл мочи в 1 ч или более, лечение фуросемидом можно продолжить, но в меньших дозах. Если же на введение фуросемида не наступило увеличения диуреза — проба отрицательная и подтверждает морфологические изменения в почках (олигоанурическая форма ОПН).
В начальной фазе уменьшается канальцевая концентрационная способность, что проявляется в снижении относительной плотности и осмолярности мочи. Постоянные величины этого отношения ниже 1,2 свидетельствуют об угрозе недостаточности почек.
Снижение клубочковой фильтрации определяется по клиренсу эндогенного креатинина (Ккр). Нормальные величины Ккр составляют 20— 120 мл/мин. При Ккр ниже 30 мл/мин происходит увеличение мочевых катаболитов в крови. Часовой диурез может оставаться в пределах нормы и обычно больше 30 мл/ч.
Для поддержания осмотической регуляции недостаточно того минимума воды (1,5 л), который обеспечивает выделение 600 ммоль конечных метаболитов здоровой почкой. Для выделения 600 ммоль почке необходимо 2,3—2,5 л жидкости в день. Большее количество воды приводит к отекам. При малом поступлении воды происходит скопление катаболитов, что ведет к азотемии. В связи с тем что на каждые 2,5 мл введенной жидкости выделяется 1 ммоль осмотически активных веществ, в основном хлорида натрия, для поддержания осмотичности внеклеточной жидкости необходимо добавлять 30—60 ммоль натрия на 1 л вводимой жидкости и регулировать содержание остальных ионов.
Почасовой диурез > 0,5 мл/кг/ч является показателем адекватной почечной перфузии. Тубулярную функцию можно рассчитать с помощью индекса почечной недостаточности (ИПН).
ИПН = натрий мочи : отношение концентрации креатинина мочи к концентрации креатинина плазмы.
Если концентрация натрия в моче < 20 ммоль/л, соотношение креатинин мочи/креатинин плазмы > 40, осмолярность мочи > 500 мосм/л, соотношение мочевина плазмы/креатинин > 100, то тубулярная функция в пределах нормы,ИПН < 1. Подъем креатинина плазмы наступает через 12—24 ч после шокового инцидента. Скорость гломерулярной фильтрации при этом должна быть ниже 50 % по сравнению с нормальной.
Фаза выраженной почечной недостаточности. Возникают морфологические изменения канальцевого эпителия. Для «шоковой почки» характерны следующие клинические признаки:
• олигурия — часовой диурез меньше 30 мл, а суточный меньше 500 мл;
• олигоанурия — суточный диурез меньше 100 мл;
• анурия — мочи нет или выделяется несколько миллилитров в сутки;
• резкое снижение клубочковой фильтрации — уменьшение клиренса креатинина ниже 5 мл/мин;
• возрастание уровня креатинина и мочевины в крови, гиперкалиемия, метаболический ацидоз;
• в 20—40 % случаев сохранен диурез.
Лечение. Основа лечения — коррекция водно-электролитного баланса. Ежедневное введение жидкости не должно превышать 500—700 мл. Дополнительные потери (через дренажи, фистулы, при обильном потении) должны быть возмещены. В этой фазе ОПН возможны осложнения: гипергидратация (отек легкого), гиперкалиемия, метаболический ацидоз, инфекционные осложнения.
Из инфузионных растворов предпочтение отдается растворам cахаров, не содержащих электролитов. По возможности надо давать жидкость внутрь. Растворы, содержащие калий, противопоказаны. Электролиты вводят по показаниям — в случае их больших внепочечных потерь или нарушений ионограммы. Необходимо контролировать гематокрит, концентрацию белка в плазме, ЦВД, массу тела. Увеличение последней свидетельствует о гипергидратации. Очень важно контролировать уровень калия в плазме. Уровень калия в плазме выше 7 ммоль/л при одновременном повышении уровня мочевины в плазме и метаболическом ацидозе служит показанием к диализу. Гидрокарбонат применяется в очень небольшой дозе (10—30 ммоль) при очень тяжелом метаболическом ацидозе, дефицит оснований компенсируется лишь частично (опасность гипернатриемии и задержки жидкости). Большое значение придают диете. Для больных с ОПН показана диета с достаточным калоражем и белками. При парентеральном питании ежедневное введение аминокислот, углеводов и ксилитола вместе с другими жидкостями не должно превышать 500 мл.
Повышение содержания остаточного азота в крови вплоть до развития уремии может возникать при многих заболеваниях и состояниях, сопровождающихся деструкцией тканей, осложнениями послеоперационного периода, сепсисе, желудочно-кишечных кровотечениях, лечении кортикостероидами и цитостатическими средствами.
Лечение ОПН при этих состояниях проводится так же, как и почечной недостаточности, вызванной шоком.
Глава 21
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
КОС — сбалансированный процесс образования, буферирования и выделения кислот.
Этот показатель можно определить по концентрации (активности) водородных ионов (Н+). Концентрацию H+ выражают в миллимолях (ммоль) или наномолях (нмоль).
Интегральный показатель КОС — рН, предложенный С. Сёренсеном в 1909 г., является отрицательным десятичным логарифмом концентрации Н+ Количество H+ в крови колеблется от 160 до 20 нмоль/л, рН равно в норме 6,8—7,7.
Прямое измерение РСО3 с помощью электрода Дж.Северигхауза позволяет быстро и точно определять дыхательный компонент КОС.
Интегральным метаболическим компонентом является избыток или дефицит оснований — показатель, наиболее точно отражающий метаболический компонент КОС. Этот показатель (BE) зависит от содержания анионов гидрокарбоната (НСО3).
Содержание ионов H+ в плазме крови определяется соотношением РСО3 и концентрации ионов НСО3. Это соотношение можно выразить следующим образом:
H+, ммоль/л = 24 x (РСО3 : НСО3).
Изменение концентрации Н+ на 1 ммоль/л приводит к изменению рН на 0,01. Отношение РСО3/НСО3 указывает на то, что содержание H+ в плазме крови прямо пропорционально концентрации НСО3. Биологический смысл компенсаторных процессов состоит в поддержании указанного соотношения на постоянном уровне. В случае изменения одного из компонентов соотношения происходят изменения другого компонента в соответствующем направлении. Повышение уровня РСО3 приводит к возрастанию содержания НСО3, а снижение РСО3 сопровождается снижением НСО3. Соответственно изменяется и уровень РСО2 плазмы крови, если первично изменяется концентрация НСО3. Эти изменения представляют собой компенсаторные реакции, ограничивающие диапазон изменений рН, но не всегда предотвращающие их.
Современная концепция кислотно-основного состояния (X. Гетген, У. Сиггаард-Андерсен). Современные представления о КОС основаны на взаимодействии клеточной и внеклеточной сред организма. Нормальное рН внутри клеток составляет 6,8 и концентрация Н+ при температуре тела 37 °С равна 158 нмоль/л. При этом концентрации Н+ и гидроксильных ионов равны и рН=рОН. Во внеклеточной жидкости рН 7,4, а концентрация Н+ — 40 нмоль/л, ионов ОН- в 20 раз меньше, чем при рН 6,8. Кровь находится в состоянии относительного алкалоза (рН 7,4).
Нормальная внутриклеточная концентрация H+ в 4 раза больше внеклеточной. Таким образом, можно полагать, что кровь и внеклеточная жидкость являются резервуаром для транспорта летучей и нелетучих кислот.
Продукция ионовH+, относящихся к тяжелым (фиксированным) кислотам, составляет около 60 ммоль/сут (700 нмоль/с). Общее количество ионов H+ во внеклеточной жидкости — 600 нмоль (40 нмоль х 15 л = 600 нмоль). Таким образом, каждую секунду в организме человека вырабатывается H+ больше их общего количества, содержащегося во всей внеклеточной жидкости. По мнению авторов, без функционирования буферной емкости крови уже через 3 с наступило бы несовместимое с жизнью состояние, поскольку концентрация H+ повысилась бы в 3 раза. Метаболический путь коррекции идет через почки, которые забирают H+ из буферов крови.
Продукция H+ в виде углеродной кислоты, т.е. «летучей кислоты», составляет приблизительно 13 000 ммоль/сут, что в 20 раз больше продукции нелетучих «фиксированных» кислот, но лишь малая часть последних становится углекислотой. Избыток H+ буферируется Hb и выводится через легкие, что составляет респираторный путь коррекции рН.
БУФЕРНЫЕ СИСТЕМЫ
Буферные системы — это биологические жидкости организма. Их защитная роль в поддержании нормального рН крови чрезвычайно велика.
Любая буферная система представляет собой смесь слабой кислоты и ее соли, образованной сильным основанием. Попадание в плазму сильной кислоты вызывает реакцию буферных систем, в результате которой сильная кислота превращается в слабую. То же происходит и при действии на биологические жидкости сильного основания, которое после взаимодействия с буферными системами превращается в слабое основание. В результате указанных процессов изменения рН либо не наступают, либо являются минимальными.
Гидрокарбонаты обеспечивают 53 % буферной способности крови, 47 % ее относятся к негидрокарбонатным системам: гемоглобиновой (35 %), протеиновой (7 %) и фосфорной (5 %). Кровь составляет только 1/5 общей буферной емкости организма.
Гидрокарбонатная система. Происхождение гидрокарбонатной системы тесно связано с метаболизмом органического углерода, поскольку конечным продуктом его является СО2 или НСО3. Гидрокарбонатный буфер является главной и единственной буферной системой интерстициальной жидкости. Образующаяся в клетках СО2 вступает в реакцию с водой, в результате чего получается угольная кислота, которая диссоциирует на ионы Н+ и НСО3. При определенных обстоятельствах (сдвиг реакции вправо или влево) будет преобладать тот или иной тип реакции:
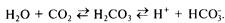
Выделение СО2 происходит через легкие, ионы H+ и НСО3 выделяются через почки. Избыточное образование СО2 ведет к усиленной элиминации его через легкие, и равновесие восстанавливается.
Гемоглобиновая система. Буферное действие молекулы гемоглобина происходит за счет имидазольной группы гистидина. Диссоциация этой имидазольной группы зависит от насыщения кислородом: оксигенированный гемоглобин (HbО2), являясь более сильной кислотой, чем деоксигенированный, отдает больше H+. Благодаря этому облегчается связывание СО2 в тканевых капиллярах и освобождение его в легочных, и транспорт СО2 происходит при меньших сдвигах рН, чем при постоянном SO2 (эффект Кристиансена — Дугласа — Холдена).
Протеиновая система. Белки плазмы, являясь амфолитами, в крови обладают свойствами кислот. Они составляют наибольшую часть пула анионов плазмы. Изменение содержания альбуминов, протеинов и аномальных белков плазмы оказывает существенное влияние на величину так называемой анионной разницы.
Фосфатная система. Эта система — первичный и вторичный фосфат (Н3РО- и НРО-) имеет значение для внутриклеточного пространства и при забуферивании мочи. Анионы РО-, как и органические кислоты, относятся к группе неизменяемых анионов, играющих важную роль в изменениях метаболического компонента КОС.
КОС и рН крови зависят от четырех факторов: продукции фиксированных (нелетучих) кислот, буферирования фиксированных кислот, элиминации фиксированных кислот, элиминации летучей (углеродной) кислоты.
Роль легких в регуляции КОС. Организм — своего рода открытая система, в которой метаболические процессы определяют интенсивность обмена энергии с внешней средой. Процессы образования СО2 в тканях, взаимодействия с гидрокарбонатным буфером и выделения СО2 легкими находятся в состоянии биологического равновесия.
Дата добавления: 2016-06-22; просмотров: 2167;











