Непищеварительные эффекты кишечной гормональной системы
Здесь мы должны отойти от принятого нами стиля и углубиться в методические детали, так как именно они определили серьезные изменения ряда важных концепций роли кишечной гормональной системы, а позднее привели к необходимости ревизии классической теории питания.
При изучении роли и функций различных эндокринных органов исследователями использован комплекс приемов. Между тем, по-видимому, только удаление какого-либо эндокринного органа дает возможность в более полной мере выявить его физиологическую роль и определить его функции, а также истинные, а не фармакологические эффекты. По этому поводу, характеризуя значение техники экстирпации для понимания функций каких-либо органов, в том числе эндокринных, И. П. Павлов в 1893 г. писал: «Чтобы определить функцию и значение для целого организма той или другой его части, эту часть удаляют из животного и наблюдают все те отклонения от нормы, которые обнаруживаются в оперированном животном. Из этих отклонений выводят заключение о роли и значении экстирпированного органа...» (с. 10). Справедливость мыслей, содержащихся в приведенном высказывании И. П. Павлова, не требует доказательств. Таким образом, мы видим, что при исследовании роли кишечных гормонов опущен такой важный и общий методический подход, как экстирпация. Для этого существовали серьезные трудности, как технические, так и теоретические.
Уже в 1950 г. один из крупнейших современных гастроэнтерологов и авторитетов в области гормонов желудочно-кишечного тракта М. Гроссман подчеркивал, что информация о гормональных функциях тонкой кишки не основана на использовании метода экстирпации, который кажется столь важным при анализе функций других эндокринных органов (Grossman, 1950). Он полагал, что дуоденэктомия или обширная резекция тонкой кишки не были использованы в связи с тем, что одновременно с выключением эндокринной системы выключаются пищеварительная и транспортная функции кишки, что затрудняет трактовку полученных результатов.
Говоря о непищеварительных, общих (или системных), функциях кишечной гормональной системы, следует заметить, что они были обнаружены во второй половине нашего столетия. Однако впервые мысль об общих эффектах кишечных гормонов была высказана еще в лаборатории И. П. Павлова, где было продемонстрировано падение кровяного давления у собак после введения в кровь экстрактов двенадцатиперстной кишки. Но затем этот сосудистый эффект был интерпретирован как результат действия гистамина.
Как известно, попытки удалить двенадцатиперстную кишку предпринимались неоднократно. Особенно известны многочисленные безуспешные попытки выдающегося русского физиолога и биохимика Е. С. Лондона, автора полифистульной техники желудочно-кишечного тракта и техники ангиостомии. В 1916 г. после таких неудачных попыток полностью удалить двенадцатиперстную кишку Е. С. Лондон предположил, что одной из возможных причин гибели животных были не только хирургические дефекты и другие осложнения, но и то, что двенадцатиперстная кишка служит источником жизненно важных веществ. Однако дуоденэктомия была в большинстве случаев успешна в том случае, если оставался хотя бы небольшой кусочек слизистой оболочки этого органа, но неизбежно кончалась гибелью животных, если осуществлялось полное удаление двенадцатиперстной кишки с пересадкой панкреатического и общего желчного протоков в тощую кишку.
В 1949-1960 гг. нам удалось решить хирургическую и экспериментальную сторону дуоденэктомии и показать следующее:1) двенадцатиперстная кишкаявляется своеобразным гипофизом брюшной полости; 2) кишечная гормональная система характеризуется не только местными (локальными), но и общими регуляторными эффектами; 3) гормоны желудочно-кишечного тракта координируют как пищеварительные процессы, так и процессы ассимиляции пищи в организме в целом. (Эти работы суммированы и подробно освещены в нашей монографии:Уголев, 1978.) В дальнейшембыло показано, что не только двенадцатиперстная кишка, но и другие отделы желудочно-кишечного тракта играют важную роль в эндокринной регуляции функций организма.
Рассмотрим более подробно основные данные, позволившие сделать далеко идущие выводы о существовании непищеварительных регуляторных эффектов кишечной гормональной системы, а позднее рассмотреть питание как взаимодействие двух витальных потоков во внутреннюю среду организма: потока нутриентов и регуляторного потока. Последний по значению и разнообразию эффектов является особенно мощным.
6.3. Эндокринная функция двенадцатиперстной кишки
Как отмечено выше, к началу 50-х годов нами были преодолены технические трудности, связанные с полным и атравматичным удалением двенадцатиперстной кишки и с пересадкой панкреатического и общего желчного протоков в тощую кишку (рис. 6.1). Такая операция была проведена нами как на кошках, так и на собаках. Некоторые кошки жили до 4-5 лет после операции, собаки - более 10 лет. Мы не будем касаться технических аспектов, они изложены в ряде специальных работ и в обзорах (Уголев, 1978, 1985). Таким образом, после устранения технических трудностей была решена проблема, стоявшая перед Е. С. Лондоном.
Однако не менее важным являлось преодоление тех сложностей, на которые обратил внимание М. Гроссман в 1950 г. (Grossman, 1950) и которые зависели от необходимости дифференцировать пищеварительно-транспортные и эндокринные дефекты у дуоденэктомированных животных. Следует напомнить, что И. П. Павлов разработал и широко использовал сочетание операций разного типа для анализа физиологических механизмов. Классическим примером такого анализа явилась дифференциация нервного и гуморального механизмов желудочной секреции путем сравнения работы павловского и гейденгайновского желудочков. Мы применили этот принцип для дифференциации эндокринных и неэндокринных функций двенадцатиперстной кишки. Дуоденэктомированные животные, у которых были выключены как пищеварительновсасывательная, так и эндокринная функции, сравнивались с нормальными неоперированными животными и с животными, у которых двенадцатиперстная кишка была изолирована, т. е. была выключена пищеварительно-всасывательная функция при сохранении гормональной. В результате сопоставления здоровых животных, животных после изоляции двенадцатиперстной кишки и ее удаления нами были обнаружены некоторые важные и в значительной мере неожиданные феномены.
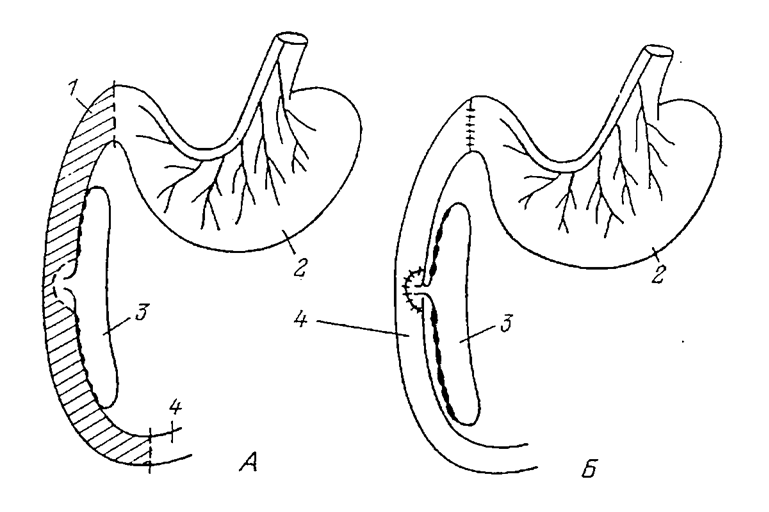
| Рис. 6.1. Схема начального (А) и конечного (Б) этапов удаления двенадцатиперстной кишки (по: Уголев, 1978). Удаляемый отрезок тонкой кишки заштрихован. 1 - двенадцатиперстная кишка; 2 - желудок; 3 - поджелудочная железа; 4 - тощая кишка. |
6.3.1. Дуоденальная недостаточность
После удаления (но не после изоляции) двенадцатиперстной кишки развивается сложное и специфическое заболевание, которое было названо нами «синдром дуоденальной недостаточности». Решающий аргумент в пользу гормональной природы этого синдрома заключался в отсутствии основных признаков этого заболевания у животных с изолированной двенадцатиперстной кишкой, т. е. с выключенными пищеварительными и транспортными функциями, но оставшимися эндокринными. Важно, что в этом синдроме преобладали признаки общих нарушений функций организма, а не местных (пищеварительно-транспортных) (обзоры: Уголев, 1978, 1985).
Дуоденальная недостаточность особенно тяжело протекает у кошек, часто со смертельным исходом, и значительно легче у собак. Различия эффектов дуоденэктомии у кошек и собак до сих пор неясны. Мы допустили, что многие эндокринные элементы у кошек локализованы в основном в двенадцатиперстной кишке, тогда как у собак более равномерно распределены в разных отделах тонкой кишки. Эта гипотеза нашла подтверждение в ряде морфологических работ, в том числе Э. Солчиа с соавторами (обзоры: Solciaetal., 1975,1987). Ниже представлена типичная картина дуоденальной гормональной недостаточности у кошек.
Дуоденальная недостаточность развивается в две фазы. Первая фаза характеризуется прогрессирующим истощением, или кахексией, которая достигает максимума примерно через 1.5 мес. (рис. 6.2). К этому времени значительная часть животных теряет до 30-50% исходной массы тела. Температура тела остается нормальной или даже снижается. Резко угнетается аппетит. Кроме того, обнаруживаются нарушения координации движений, мышечная атрофия, подергивания и судороги. В этот период до половины животных погибает, но при вскрытии в большинстве случаев не удается обнаружить каких-либо дефектов операции.
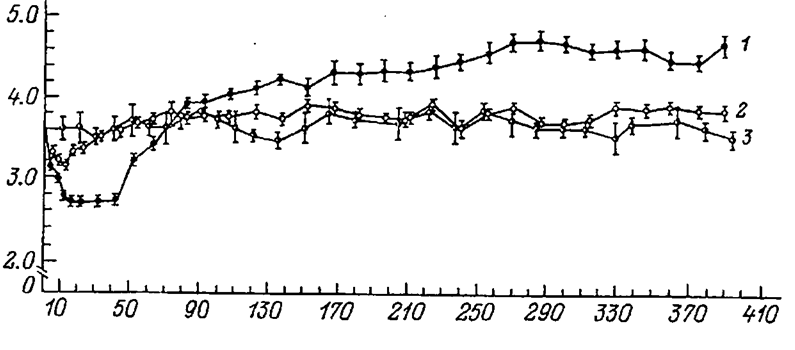
| Рис. 6.2. Масса тела у кошек после дуоденэктомии (1), изоляции двенадцатиперстной кишки (2) и у контрольных животных (3) (по: Уголев, 1978). По оси абсцисс - время после операции (сут); по оси ординат - масса тела животных (кг). |
Вторая фаза развивается у тех животных, у которых кахексический синдром выражен слабее, и они выживают. Спустя 2-3 мес. после операции у таких животных первоначальная масса тела восстанавливается, а затем развивается ожирение. В отличие от дуоденэктомированных кошек у животных с изолированной двенадцатиперстной кишкой общее состояние и исходная масса тела быстро нормализуются и в дальнейшем не отличаются от контрольных животных.
Если кахексический синдром с трудом можно объяснить нарушениями пищеварения и всасывания, то последующее ожирение на фоне восстановившегося аппетита и отсутствия диареи следует трактовать как общее заболевание, возникшее вследствие выпадения гормональных эффектов. Действительно, дуоденальную недостаточность невозможно объяснить выпадением пищеварительно-транспортных функций двенадцатиперстной кишки. При обследовании дуоденэктомированных животных и животных с изолированной двенадцатиперстной кишкой обнаружено, что лишь у первых сохраняются на протяжении всего периода наблюдения существенные нарушения многих морфологических и биохимических характеристик.
Приведем лишь некоторые примеры, характерные для животных с дуоденэктомией, но не с изоляцией двенадцатиперстной кишки. Так, при дуоденальной недостаточности наблюдаются повышение уровня холестерина в крови, повышение остаточного азота в крови кошек и понижение в крови собак, снижение белковообразовательной функции печени, нарушение обмена гликопротеинов и липидов, изменение уровня глюкозы в крови. Активность лактатдегидрогеназы, альдолазы, аспартат- и аланинаминопептидаз, кислой и щелочной фосфатаз, липазы и других ферментов также претерпевает существенные изменения. Наблюдаются нарушения водно-солевого обмена и моторно-эвакуаторной функции желудка. Важно отметить, что организм теряет способность отвечать на прием пищи развитием лейкоцитоза (см. также гл. 7).
Итак, анализ полученных данных позволяет заключить, что нарушения, возникающие после удаления двенадцатиперстной кишки, определяются выпадением эндокринных, а не пищеварительно-транспортных функций этого органа.
Выраженное ожирение после удаления двенадцатиперстной кишки напоминает таковое при некоторых поражениях гипоталамуса. Прямые исследования гипоталамо-гипофизарной системы продемонстрировали существование связей последней с двенадцатиперстной кишкой (Скворцова и др., 1973). В частности, поразительна картина супраоптического и паравентрикулярного ядер гипоталамо-гипофизарной нейросекреторной системы, которые сравнивались у здоровых животных, животных после дуоденэктомии и изоляции двенадцатиперстной кишки через различные сроки после операции (от 2 нед до 3 лет). Оказалось, что после дуоденэктомии наблюдается нарушение некоторых структурных показателей нейросекреторных ядер, причем наиболее выражены явления, характерные для застоя нейросекрета.
Ряд данных свидетельствует о наличии дуоденально-тиреоидных влияний. В частности, продемонстрированы морфологические эквиваленты гипофункции щитовидной железы, наблюдающиеся у дуоденэктомированных животных в течение длительного периода наблюдения. В щитовидной железе происходят значительное снижение высоты эпителиальных клеток, увеличение содержания коллоида и уменьшение доли секреторных элементов. Эти сдвиги сохраняются в течение нескольких лет без тенденции к восстановлению.
Были обнаружены также значительные, но постепенно компенсируемые влияния дуоденэктомии на кору надпочечников. Дуоденэктомия приводит к резким нарушениям структуры всех трех зон коры надпочечников (клубочковой, пучковой и сетчатой), уменьшению плотности расположения ядер и изменению состояния клеточных элементов. Нормализация морфологической картины коры надпочечников у дуоденэктомированных животных наблюдается лишь через 4-4.5 мес., тогда как у животных после изоляции двенадцатиперстной кишки - через 2-3 нед.
Возникновение компенсаторных процессов не опровергает важности энтеросупраадреналовых связей, но может говорить о том, что существует другой мощный контур саморегуляции. Более поздние исследования с использованием абдоминального препарата и хирургии exvivoпозволили понять возможный механизм компенсации нарушений функций надпочечников после дуоденэктомии (см. 6.4).
Таким образом, полученные результаты свидетельствуют о существовании не только местных, но и общих эффектов гормональной системы двенадцатиперстной кишки. Это делает противоречивой существующую классификацию кишечных гормонов. Поэтому мы предложили объединить все кишечные гормоны родовым названием «энтерин», дополняя такое название описанием основных эффектов гормона. Дуоденальную недостаточность следует дифференцировать на недостаточность пищеварительно-транспортных функций двенадцатиперстной кишки и энтериновую недостаточность, т. е. недостаточность эндокринных элементов тонкой кишки (гипоэнтеринизм). Существуют сведения, что гипоэнтеринизм может развиваться не только у животных, но и у человека (обзоры:Уголев,1978, 1985).
Анализ синдрома дуоденальной недостаточности позволил установить, что двенадцатиперстная кишка контролирует ряд важнейших метаболических функций организма в значительной степени через гипоталамические центры. Тем не менее первоначально было трудно объяснить факт, полученный нами совместно с A. Л. Поленовым и Н. Б. Скворцовой, о нарушениях нейросекреторной функции гипоталамических ядер и передаче нейросекрета после дуоденэктомии (Скворцова и др., 1973). Свести интерпретацию к действию непроникающего через гематоэнцефалический барьер холецистокинина не представлялось возможным. Нами было высказано предположение о существовании специального гипоталамотропного гормона или группы гипоталамотропных энтеринов, один из которых был назван нами аппетитрегулирующим энтерином - арэнтерином, а другой - динамизирующим энтерином - динэнтерином (см. гл. 7 и 8). Накапливается все больше данных, что двенадцатиперстная кишка является центром эндокринной регуляции органов брюшной полости и одним из центров эндокринной регуляции жизнедеятельности всего организма. Иными словами, по составу гормонов и с учетом нейрональных элементов гипоталамо-гипофизарной системы двенадцатиперстная кишка как эндокринный орган напоминает гипофиз, и поэтому мы первоначально охарактеризовали ее как «гипофиз брюшной полости» (обзор: Уголев, 1978).
Результаты, полученные при сопоставлении ряда характеристик животных после дуоденэктомии и после изоляции двенадцатиперстной кишки, позволили постулировать существование дуоденально-нейрональной (особенно дуоденально-гипоталамической), дуоденально-тиреоидной, дуоденально-адреналовой, дуоденально-инсулярной, дуоденально-билиарной и других осей (или связей). Наличие таких осей получило подтверждение в более поздних работах с помощью радиоиммунологических, иммуногистохимических и других методических приемов (обзоры: Уголев, 1978, 1985). Кроме того, можно высказать предположение о существовании дуоденально-стероидной оси ( см. 6.4).
Изучение кишечной гормональной системы с помощью экспериментально-хирургической техники в сочетании с другими аналитическими подходами делает свои первые шаги, а задачи, стоящие перед исследователем, столь же интересны, сколь и трудны. Однако, как можно заключить из этого очень краткого описания синдрома дуоденальной недостаточности, общие гормональные эффекты двенадцатиперстной кишки чрезвычайно важны и разнообразны. Вместе с тем хирургическая техника не давала возможности делать какие-либо заключения о химической структуре и ограничивала выводы оценкой физиологической роли факторов, продуцируемых удаленными органами. Поэтому ее сочетание с другими методическими подходами представляется особенно привлекательным.
6.4. Характеристика гормональных функций желудочно-кишечного тракта, полученная методом изолированного абдоминального препарата exvivo
В течение последних лет были достигнуты значительные успехи в исследовании кишечной гормональной системы благодаря применению иммуногистохимических методов. Они позволили установить присутствие и точную локализацию в эндокринных клетках всех отделов желудочно-кишечного ” тракта большого числа регуляторных пептидов, а также регуляторных аминов. Кроме того, с помощью этих методов выявлено, что многие химические мессенджеры, которые ранее считались исключительно гипоталамо-гипофизарными факторами, продуцируются также и эндокринными клетками желудочно-кишечного тракта. Изучение точной локализации ряда гормонов в тканях позволило решить вопрос об их происхождении. Было показано, что многие гормоны являются продуктом секреторной деятельности клеток желудочно-кишечного тракта, тогда как другие входят в состав нейросекретов и служат нейромедиаторами.
Ряд так называемых пищеварительных гормонов имеет двоякое происхождение и двойную функцию, т. е. являются и гормонами, продуцируемыми эндокринными клетками пищеварительного аппарата, и в то же время нейротрансмиттерами (обзор:Dockray,1987, и др.). В их число входят ВИП, холецистокинин, гастрин и многие другие. В некоторых случаях удалось обнаружить наличие изогормонов. Так, для секретов клеток желудочно-кишечного тракта характерны одни изогормоны, для медиации в нервных синапсах используются другие. Вместе с тем с помощью традиционных методов во многих случаях не удавалось дифференцировать собственно эндокринные, паракринные и медиаторные функции многих физиологически активных веществ. Это удалось сделать методом сосудистой перфузии комплекса изолированных органов брюшной полости - абдоминального комплекса. В начале 80-х годов нами совместно с В. Г. Смагиным, В. А. Виноградовым, С. А. Булгаковым, Г. М. Бобковым и Г. М. Рощиной был использован изолированный абдоминальный препарат крыс (рис. 6.3), что позволило более подробно охарактеризовать ряд гормональных функций пищеварительной системы. Детальная характеристика этого методического подхода дана в отдельных работах (Булгаков и др., 1981, 1982) и в нашей сводке (Уголев, 1985). Первоначально этот метод был разработан нами для исследования пищеварительной системы собак (Уголев и др., 1981), а затем адаптирован для крыс.
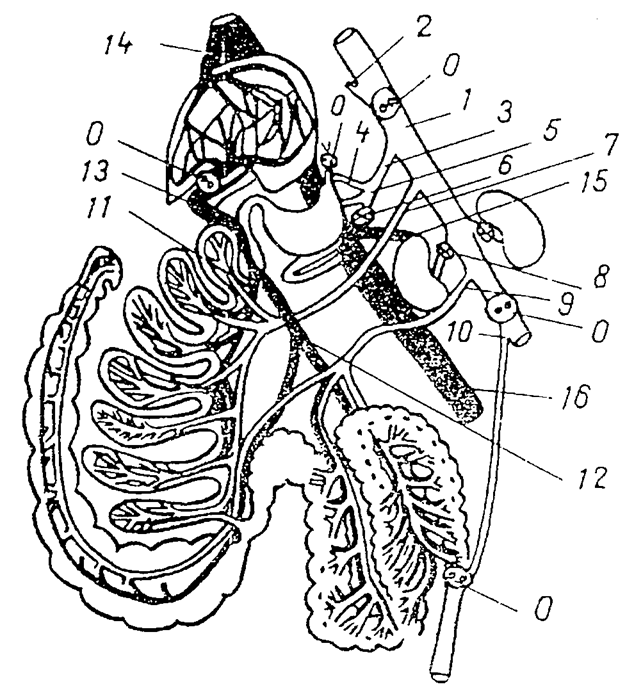
| Рис.6.3. Схема изолированного абдоминального препарата крысы (по: Уголев и др., 1984). Артерии изображены светлым, вены - темным. О - место наложения лигатуры и перерезки сосуда, пищевода или прямой кишки; 1 - брюшная аорта; 2 -каудальная диафрагмальная артерия; 3 - чревная артерия; 4 - желудочная артерия; 5 - печеночная артерия; 6 - селезеночная артерия; 7 - краниальная брыжеечная артерия; 8 - почечная артерия; 9 - каудальная брыжеечная артерия; 10 - артерия прямой кишки; 11 - краниальная кишечная вена; 12 - каудальная кишечная вена;13 -воротная вена печени; 14 - печеночная вена; 15 - почечная вена; 16 - каудальная полая вена. |
Абдоминальный комплекс состоял из следующих органов: нижней части пищевода, желудка, двенадцатиперстной кишки с впадающими в нее протоками и поджелудочной железой, тонкой кишки и части толстой кишки, получающей кровоснабжение от брюшной аорты.
Таблица 6.2
Концентрации гормонов в оттекающей жидкости при перфузии изолированного абдоминального комплекса крыс (по: Булгаков и др., 1981)
| Гормон (пг/мл) | Время после начала перфузии (мин) | |||
| Инсулин (мкед/мл) | ||||
| Гастрин | ||||
| Соматостатин | 3.6 | 3.2 | 4.9 | |
| Альдостерон | ||||
| Т естостерон | ||||
| Эстрадиол | 3.6 | 3.5 | 4.0 | 5.5 |
Примечание. Приведены средние данные 3 опытов.
Для изучения эндокринных функций желудочно-кишечного тракта сочетались перфузия изолированного абдоминального комплекса с радиоиммунологическим определением гормонов в оттекающем перфузате. Результаты представлены в табл. 6.2.
В оттекающем перфузате обнаружен инсулин, концентрация которого приблизительно соответствовала его уровню в крови. Концентрация гастрина в среднем превышала уровень в крови в 2-3 раза. Содержание соматостатина было ниже уровня, определяемого в периферической крови. В незначительных количествах, приблизительно в 10 раз ниже уровня в крови, присутствовали в перфузате тестостерон и эстрадиол. Неожиданно высоким оказался уровень альдостерона, концентрация которого в перфузате была сопоставима с уровнем в крови. Косвенно в пользу секреции альдостерона свидетельствует характерная динамика его выделения, сходная с таковой инсулина, секреция которого абдоминальным препаратом вряд ли вызывает сомнения. Таким образом, можно предположить возможность желудочно-кишечного происхождения определяемого в оттекающем перфузате альдостерона. В то же время это предположение, имеющее далеко идущие выводы, нуждается в тщательной проверке.
Разработанный нами методический прием позволяет устранить многие неточности в интерпретации содержания в крови некоторых гормонов, обусловленные наличием клеток, продуцирующих одноименные гормоны не только в желудочно-кишечном тракте, но и в других органах, например в мозге. Такая множественная локализация эндокринных клеток продемонстрирована для гастрина, соматостатина, инсулина и многих других пептидных и непептидных гормонов. Столь же существенна возможность разделения с помощью предлагаемого метода эндокринной, паракринной и медиаторной функций физиологически активных веществ в желудочно-кишечном тракте.
Итак, развиваемый методический подход подтверждает истинную эндокринную роль гастрина и инсулина, которые в достаточных количествах секретируются в сосудистое русло. В то же время исследования «абдоминального» соматостатина не дают оснований для подобного заключения, так как уровень этого пептида в перфузате низок и непостоянен, что, возможно, здесь отражает его преимущественно паракринную функцию. Не исключено, что этот пептид в данном случае служит локальным регулятором.
Ранее было упомянуто, что двенадцатиперстная кишка по своим эндокринным функциям напоминает гипоталамо-гипофизарную систему и может вырабатывать факторы, сходные по физиологическим эффектам с тропными гормонами гипофиза. В частности, нами предполагалось, что она может быть источником АКТГ-подобного фактора. Через много лет наличие в желудочно-кишечном тракте АКТГ-подобных пептидов было показано с помощью иммунохимических методов (Larsson, 1979, 1981). Но эта техника не позволяла решить вопрос о секреции кишечного АКТГ в кровь и, следовательно, определить физиологическую значимость этого гормона.
В одном из циклов наших экспериментов предпринята попытка решить вопрос о том, секретируется ли АКТГ кишечного происхождения в кровь, т. е. является ли он истинным гормоном? Результаты опытов представлены в табл. 6.3. Важно отметить большое количество АКТГ-подобной иммунореактивности в оттекающей жидкости, полученной при перфузии абдоминального комплекса контрольных крыс. Уровень АКТГ превышал концентрацию этого гормона в крови в несколько раз. После адреналэктомии уровень АКТГ в перфузате резко возрастал, увеличиваясь по сравнению с контрольными опытами на 177-443%. Такое повышение концентрации АКТГ не может получить объяснения в свете неспецифических изменений состояния самого абдоминального комплекса, поскольку одновременно наблюдаются противоположные изменения концентрации инсулина (его уровень снижается) и остается неизменным содержание гастрина. У контрольных животных с интактными надпочечниками при перфузии изолированного абдоминального комплекса в перфузате обнаружены как гастрин, так и инсулин. Адреналэктомия не приводила к изменению уровня гастрина в перфузате. Концентрация инсулина в перфузате после адреналэктомии значительно снижалась. Выделение основных пептидных гормонов желудочно-кишечного тракта, использованных нами для характеристики эндокринной активности изолированного абдоминального комплекса, а именно гастрина и инсулина, подчиняется ранее известным закономерностям и соответствует данным литературы, полученным при использовании других экспериментальных моделей.
Таблица 6.3
Концентрация гормонов в оттекающей жидкости при перфузии изолированного абдоминального комплекса крыс (по: Булгаков и др., 1982)
| Гормон | Группа животных | Время после начала перфузии (мин) | |||
| Гастрин (пг/мл) | Контроль Адреналэктомия | 14.8 17.5±7.0 | 13.7 11.7±6.9 | 13.8 13.4±7.1 | 10.2 18.6±9.0 |
| Инсулин (мкед/мл) | Контроль Адреналэктомия | 17.0 5.9±2.9 | 13.2 6.2±2.4 | 16.3 5.1±3.1 | 15.1 6.0±2.9 |
| АКТГ (пг/мл) | Контроль Адреналэктомия | 858±619 | 1435±612 | 1098±719 | 673±641 |
Примечание. В контрольном варианте приведены средние данные 5 опытов
По нашему мнению, использование перфузии изолированного абдоминального комплекса позволило во многом преодолеть недостатки иммунохимических методов, так как определение гормонов в перфузате проводилось в условиях, когда присутствие других тканевых белков минимально. Особенно интересным фактом является увеличение уровня АКТГ в перфузате после адреналэктомии. Повышение уровня АКТГ в крови после этой операции принято связывать с разрывом контура обратной связи гипофиз-надпочечники. Но наблюдавшиеся нами изменения могут быть расценены по-другому, а именно как компенсаторная реакция АКТГ-продуцирующих клеток кишечника на адреналэктомию. Иными словами, эндокринные клетки кишечного тракта могут вносить свой вклад в адаптивное увеличение уровня АКТГ в крови после адреналэктомии.
Таким образом, нами обнаружена секреция АКТГ-подобной иммунореактивности изолированным абдоминальным комплексом, что свидетельствует в пользу истинной эндокринной роли кишечного АКТГ. При этом опыты с адреналэктомией указывают на возможную общность механизмов, регулирующих секрецию АКТГ клетками гипофиза и желудочно-кишечного тракта.
В настоящее время еще трудно решить вопрос, как далеко простирается аналогия между желудочно-кишечным трактом и гипоталамо-гипофизарной системой. В ряде последних опытов с использованием техники, описанной выше, нами установлено, что в оттекающем перфузате присутствует иммунореактивность, сходная с Т3 (трииодтиронин) и Т4 (тироксин). Так, по данным 5 опытов концентрация Т3 составила (0.48±0.18), а Т4 - (8.2±4.1) мкг%. Кроме того, в перфузате обнаружена иммунореактивность, подобная лей-энкефалину. Уровень последнего широко варьирует, меняясь от 55 до 514 пг/мл. Однако в отличие от АКТГ для этих факторов еще не выявлены существенные адаптивные изменения секреции, которые служат важным признаком физиологической значимости процесса.
Таким образом, в настоящее время можно утверждать, что клетки желудочно-кишечного тракта продуцируют сходные или идентичные гипоталамо-гипофизарными гормонамАКТГ и тиреотропный гормон. Следовательно, гипоталамо-гипофизарные факторы оказались гормонами желудочно-кишечного тракта.С другой стороны, те гормоны, которые прежде казались по происхождению исключительно желудочно-кишечными, затем были обнаружены в нервных структурах и некоторых других тканях организма.
Дата добавления: 2016-06-22; просмотров: 2175;











