Устойчивость атомных ядер
Характеристики атомов и их ядер
Структура атомов
Все вещества, существующие в природе, состоят из атомов. Обычно атом изображают в виде ядра, расположенного в центре электронного облака, которое представляет собой набор электронных оболочек, состоящих из вращающихся по орбитам электронов (рис. 1.1).
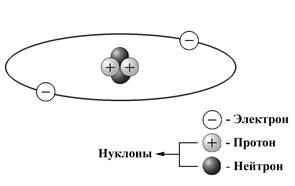
Рис. 1.1. Структура атома гелия 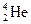
Атомное ядро – это простейшая структура, которая определяет химические и физические характеристики атомов. Согласно современным представлениям, ядро представляет собой тесно связанные между собой нуклоны – протоны (p) и нейтроны (n). Протоны и нейтроны имеют почти одинаковые массы (нейтрон немного тяжелее протона), но различаются зарядом.
Протон имеет положительный заряд, равный по величине одному элементарному заряду +1. Нейтрон – нейтральная, не имеющая заряда частица. Заряд ядра равен сумме зарядов находящихся в нем протонов. В атоме вокруг ядра вращается столько электронов, сколько протонов содержится в ядре. Электрон – легкая частица. Его масса в 1836 раз меньше, чем масса протона или нейтрона, поэтому масса атома целиком определяется массой его ядра. Электрон представляет собой отрицательно заряженную частицу с элементарным зарядом –1, поэтому атом в целом электрически нейтрален.
Описанная модель атома называется планетарной. В табл. 1.1 показаны обозначения составляющих атом частиц, которые приняты в современной ядерной физике.
Таблица 1.1
Частицы, входящие в состав атомов
| Частица | Положение в атоме | Заряд | Обозначение |
| Нейтрон | Ядро | Нет | 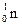
|
| Протон | Ядро | +1 | 
|
| Электрон | Оболочка вокруг ядра | –1 | 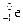
|
Химические свойства атомов и способность их соединяться друг с другом, образуя молекулы, зависят от числа электронов в атоме, от того, как они связаны с ядром, как распределены по оболочкам.
Принято обозначать число протонов в ядре или число электронов в оболочке атома буквой Z, а число нейтронов – буквой N.
| Массовое число | 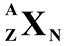
| Химический символ элемента |
| Зарядовое число | Число нейтронов | |
Пример:  или или 
|
Общее число нуклонов в ядре Z+N называют массовым числом и обозначают буквой А: А = Z+N. На рис. 1.2 показано расположение А, Z и N относительно химического символа элемента Х в принятом обозначении атомов.
Рис. 1.2. Основные символы в обозначении атомов
Заряд ядра, величина которого определяется числом протонов Z, – основная характеристика атома, определяющая его принадлежность к определенному элементу. Разновидности одного и того же химического элемента, различающиеся количеством нейтронов N в ядре, называются изотопами. Например, у обычного водорода ядро представляет собой один протон. Если к протону присоединить один нейтрон, получим ядро тяжелого водорода – дейтерия, а если присоединить два нейтрона, получим сверхтяжелый водород – тритий (рис. 1.3).
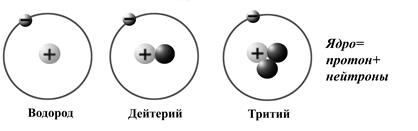
Рис. 1.3. Изотопы водорода
Встречающиеся в природе химические элементы почти всегда состоят из смеси нескольких изотопов, содержание которых обычно указывается в процентах, как, например, в табл. 1.2.
Таблица 1.2
Стабильные изотопы свинца
| Нуклид | Протоны | Электроны | Нейтроны | % содержания |
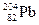
| 1.4 | |||
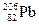
| 25.1 | |||
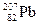
| 21.7 | |||
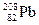
| 52.3 |
Ядра некоторых изотопов могут долгое время обладать повышенной внутренней энергией и находиться в метастабильном состоянии. Ядра, находящиеся в метастабильном состоянии, называют ядерными изомерами. Они имеют такое же число протонов и нейтронов, как и ядро в нормальном состоянии, но обладают дополнительной внутренней энергией. При обозначении изомера к массовому числу добавляют прописную английскую букву «m», например, изомер 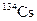 обозначают как
обозначают как 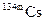 .
.
Изотопы одного элемента обладают одинаковыми свойствами, которые определяются его положением в периодической системе элементов, принятой на основе периодического закона Д. И. Менделеева (табл. 1.3).
Таблица 1.3
Периодическая система элементов Д.И. Менделеева
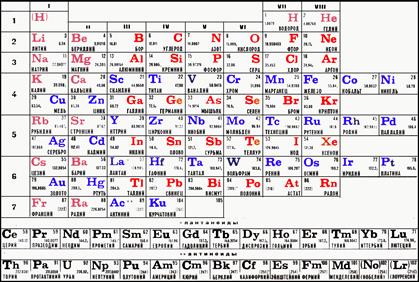
Этот закон устанавливает периодичность изменения строения электронных оболочек атомов, что обусловливает периодичность химических свойств элементов. В периодической системе элементов каждому химическому элементу принадлежит номер, совпадающий с количеством протонов Z в ядре, а атомная масса указывается с учетом изотопного процентного состава элемента. Вертикальные колонки периодической таблицы (обозначаются римской цифрой) содержат элементы со сходным строением внешних электронных оболочек, что обусловливает сходность их химических свойств. Например, все элементы VIII группы имеют полностью заполненные оболочки, поэтому ведут себя как химически инертные вещества. Элементы VII группы – неметаллы, которые образуют отрицательные ионы с зарядом, равным –1, и обладают высокой химической активностью. Элементы I группы – щелочные металлы, которые образуют положительные ионы с зарядом, равным +1, и обладают очень высокой химической реакционной способностью.
Устойчивость атомных ядер
Все ядра можно подразделить на стабильные или устойчивые, которые могут существовать триллионы лет и более без всяких изменений, и нестабильные или неустойчивые, которые с течением времени превращаются в другие ядра с испусканием какой-либо частицы. В настоящее время известно 256 стабильных изотопов всех химических элементов и более 2000 искусственно полученных нестабильных изотопов. Изотоп с данными Z и N называют нуклидом, а если изотоп нестабильный, то радионуклидом. Например, свинец имеет четыре стабильных нуклида (табл. 1.2) и двадцать радионуклидов. Некоторые элементы имеют только по одному стабильному изотопу, например, бериллий, натрий, алюминий, марганец, йод и некоторые другие, а такие элементы как кадмий, теллур – по восемь, олово – десять.
Если все известные нуклиды поместить в одну таблицу, в каждой клеточке которой разместить по одному нуклиду таким образом, чтобы номер соответствующего столбца был равен нейтронному числу N, а номер строки – протонному числу Z, мы получим таблицу нуклидов. Начальный участок такой таблицы представлен на рис. 1.4. Все стабильные нуклиды располагаются в такой таблице вдоль сравнительно узкой полосы, именуемой дорожкой стабильности, как показано на рис. 1.5.
В табл. 1.4 приведена одна строка таблицы нуклидов, принадлежащая цезию. Цезий имеет один стабильный изотоп  . В таблице представлены[1] восемь изотопов, обедненных нейтронами, и семь, обогащенных нейтронами по сравнению со стабильным изотопом.
. В таблице представлены[1] восемь изотопов, обедненных нейтронами, и семь, обогащенных нейтронами по сравнению со стабильным изотопом.
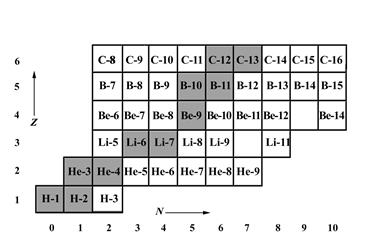
Рис. 1.4. Начальный участок таблицы нуклидов
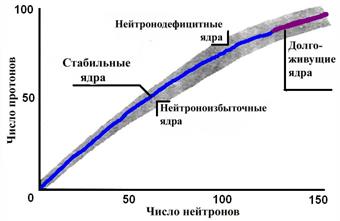
Рис. 1.5. Протонно-нейтронное отношение в ядрах
В оболочках легких нуклидов в стабильных ядрах число протонов и число нейтронов почти одинаково, т.е. Z » N. Начиная с А> 40, как правило, N > Z. Необходимо подчеркнуть, что все ядра с Z > 83 (после висмута) нестабильны, кроме того ядра с Z = 43 (технеций) и Z = 61 (прометий) также не имеют ни одного стабильного изотопа. При А= 209 (  ) дорожка стабильности заканчивается, что на рис. 1.5 обозначено как область с долгоживущими нуклидами.
) дорожка стабильности заканчивается, что на рис. 1.5 обозначено как область с долгоживущими нуклидами.
Таблица 1.4
Стабильный и радиоактивные изотопы цезия
| Изотоп | Протоны | Нейтроны | Т1/2 | Тип распада |
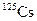
| 45 мин | ЭЗ, b+ | ||
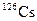
| 1.64 мин | ЭЗ, b+ | ||
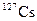
| 6.25 ч | ЭЗ, b+ | ||
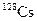
| 3.9 мин | ЭЗ, b+ | ||

| 32.06 ч | ЭЗ, b+ | ||
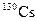
| 29.9 мин | ЭЗ, b+ | ||
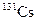
| 9.69 сут | ЭЗ | ||
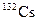
| 6.475 сут | ЭЗ, b+, b– | ||
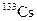
| Стабильный | Нет | ||
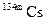
| 2.90 ч | ИП | ||
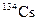
| 2.062 лет | ЭЗ, b– | ||
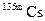
| 53 мин | ИП | ||
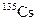
| 2.36 г | b– | ||
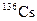
| 13.1 сут | b– | ||
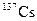
| 30.0 лет | b– | ||
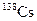
| 32.2 мин | b– |
Дата добавления: 2020-03-17; просмотров: 1276;











