Обработка воды методом ионного обмена. Технология ионного обмена
Обработка воды методом ионного обмена. Для удаления ионизированных примесей (растворенных солей) используются ионообменные материалы (иониты), которые способны изменять ионный состав воды в желаемом направлении.
Зерно ионообменной смолы - агрегат из макромолекул, обладающих ярко выраженными кислотными или основными свойствами (рис. 3.3.9). В одном случае каждую молекулу смолы можно рассматривать как анион очень больших размеров, неподвижный, нерастворимый, связанный с водородными ионами (Н+), которые могут вступать в обменные реакции. Агрегат из таких молекул составляет зерно катионита К, условно обозначаемого HR.
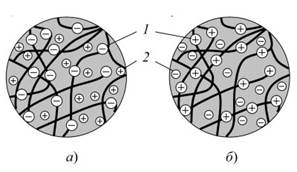
Рис. 3.3.9. Схема распределения зарядов в зернах катионита (а) и анионита (б): 1 - фиксированные ионы матрицы (отрицательно заряженные у катионита и положительно заряженные у анионита); 2 - обменивающиеся противоионы
Ион водорода находится не только на поверхности зерна. Вода может проникать в него, ионизируя во всем его объеме атомы водорода в ионообменных группах (например, группах SO3H). На место ионов Н+ будут становиться катионы примесей, проникающие вместе с молекулами воды из внешнего раствора в глубь зерна (рис. 3.3.10):
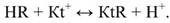
Ионы водорода диффундируют из зерна ионита в обрабатываемую воду, делая ее кислой.
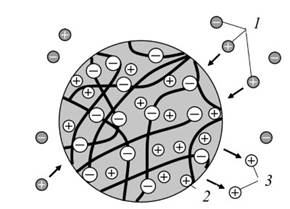
Рис. 3.3.10. Схема ионообмена в зерне ионита: 1 - ионы раствора; 2 - ионы раствора, перешедшие в ионит; 3 - ионы ионита, перешедшие в раствор
Аналогично катионитам, смолы, содержащие в своем составе гидроксильную группу, - это аниониты А, в структуре которых имеется большой неподвижный катион R+ и связанный с ними, способный к обмену гидроксильный ион ОН- . Обменная реакция на анионите протекает по следующей схеме:
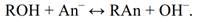
Представление об ионитах как твердых электролитах определяет основанные закономерности ионного обмена, такие как эквивалентность обмена, обратимость ионообменных реакций и селективность (избирательность) при обмене с ионами нескольких типов.
Технология ионного обмена. Одной из основных технологических характеристик ионообменных смол является обменная емкость, определяемая числом активных функциональных групп, внедренных в структуру ионита, выраженная обычно в г х экв обмениваемых ионов на 1 м3 ионита. Этот показатель позволяет составить материальный баланс работы ионитного фильтра, т.е. определить количество воды, которое можно в нем обработать, а также рассчитать продолжительность рабочего цикла фильтра.
В теплоэнергетике природную воду для промышленного использования приготавливают методом химического (ионообменного) обессоливания, пропуская ее последовательно через катионитные фильтры, у которых обменным ионом является ион водорода, и анионитные фильтры, загруженные анионитом в гидроксильной форме.
При пропуске воды через Н-катионитные фильтры все присутствующие в ней катионы (Са2+, Mg2+, N+ и др.) заменяются эквивалентным количеством ионов водорода:
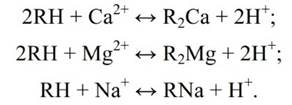
Полученную кислую воду, содержащую анионные примеси (Cl- , SO42- , НСО3- , HSiO3- и др.), пропускают затем через анионитные фильтры, в которых происходит обмен анионов примесей на ион гидроксила, переходящий в обработанную воду:

Ионы водорода и гидроксила не могут существовать совместно в произвольных количествах, так как вода представляет собой очень слабый электролит. Поэтому конечным продуктом реакции обмена ионов в рассматриваемой схеме являются молекулы воды. В итоге в обработанной воде не остается ионизированных примесей. Такую воду называют обессоленной, ее солесодержание не превышает обычно 1 мг/кг (или мг/л).
После исчерпания способности к обмену ионами ионообменные смолы подвергают регенерации. Для этого через катионит пропускают раствор сильной кислоты (H2SO4 NHО3 и др.), а через ионит - раствор щелочи (NaОН, КОН). Содержащиеся в регенерационных растворах ионы H+ и ОН- ввиду обратимости ионообменных реакций вытесняют соответственно из катионита и анионита поглощенные за рабочий цикл ионы-примеси.
Кроме химического обессоливания воды ионитная обработка используется для умягчения воды, т.е. для удаления из нее ионов кальция и магния, характеризующих такой показатель качества воды, как жесткость. В этом случае воду фильтруют через катионит в исходной натриевой форме:
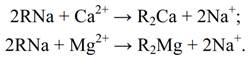
После истощения Na-катионита, т.е. обмена всех ионов натрия, находившихся в смоле, на ионы Са2+ и Мg2+, проводят регенерацию катионита (восстановление его исходного состояния) путем обработки раствором NaСl:
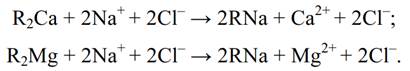
Процессы ионообменной очистки воды проводят в фильтрах (рис. 3.3.11). Как и осветлительный фильтр, ионитные фильтр состоит из цилиндрического корпуса, верхнего и нижнего распределительных устройств, подводящих и отводящих воду и реагенты трубопроводов с арматурой. Кроме того, фильтр комплектуется контрольно-измерительной аппаратурой (манометрами, расходомерами, устройствами отбора проб, автоматическими приборами химического контроля).
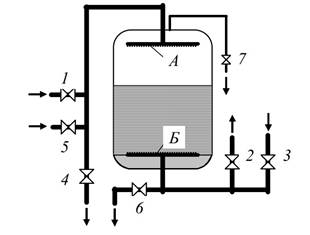
Рис. 3.3.11. Схема прямоточного ионитного фильтра: А - верхнее распределительное устройство; Б - нижнее распределительное устройство; 1, 2 - вход и выход обрабатываемой воды; 3,4 - вход и выход взрыхляющей воды; 5 - вход свежего регенерационного раствора; 6 - выход отработанного регенерационного раствора; 7 – воздушник
В тех случаях, когда исходная природная вода является высокоминерализованной, т.е. содержит растворенные соли в концентрации более 600...700 мг/кг, рабочие циклы в фильтрах химического обессоливания становятся короткими, на их частую регенерацию расходуется большое количество реагентов. Это делает технологию химического, ионитного обессоливания таких вод малоэкономичной и вызывает необходимость использования других способов обессоливания воды, таких как термический и мембранный.
Дата добавления: 2024-06-08; просмотров: 514;











