Условия возникновения горения жидкостей
В огромных количествах горючие жидкости добываются, транспортируются, хранятся, перерабатываются и используются в народном хозяйстве страны. Основным их источником являются нефть и газовый конденсат, объем добычи, которых сейчас у нас в стране составляет более 300 млн. т. Такое количество нефти и конденсата транспортируется, хранится, перерабатывается и потребляется во многих отраслях народного хозяйства - в нефтеперерабатывающей, нефтехимической, химической промышленности и других, на всех видах транспорта и в быту.
Жидкости обладают большой пожарной опасностью. Для эффективной защиты их от пожаров требуются глубокие знания закономерностей возникновения и развития процессов горения.
Характерной особенностью практически всех горючих жидкостей является способность их к испарению при любых условиях. Над поверхностью горючих жидкостей всегда находятся их пары, которые, смешиваясь с воздухом, могут образовать взрывоопасные смеси. Такое состояние жидкостей приводит к тому, что пожарная их опасность представляет опасность двоякого рода: в одном случае происходит только вспышка паров, а в другом - вспышка паров и возникновение устойчивого горения самой жидкости.
Реакция горения жидкости начинается и протекает сложнее, чем у газов. Представим себе, что жидкость налита в открытый сосуд (рис.1.1). Жидкости непрерывно испаряются даже при низких температурах. Поэтому над зеркалом жидкости всегда присутствует парообразная смесь с воздухом за счет того, что часть молекул на поверхности, которые имеют большую кинетическую энергию, покидают жидкость и смешиваются с воздухом. При этом поверхность жидкости охлаждается. За счет теплового движения молекулы постепенно распространяются за пределы открытого сосуда. Плотность пара жидкостей по воздуху больше единицы, т.е. пар тяжелее воздуха. Он оседает вниз, скапливаясь на поверхности земли, пола и т.п. В результате длительного испарения могут образовываться взрывоопасные паровоздушные облака очень большой протяженности - до нескольких десятков и даже сотен метров.
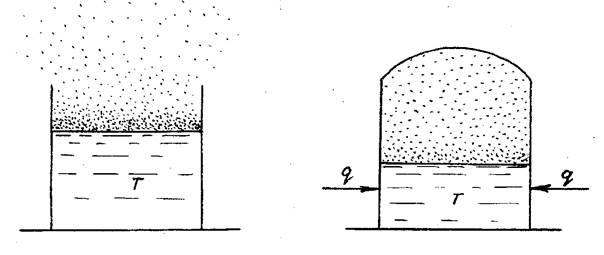
Рис.1. Схема испарения жидко- Рис.2. Схема парообразования
сти из открытого сосуда в закрытом сосуде
Пар по своим свойствам во многом аналогичен газу, поэтому его пожарная опасность характеризуется всеми показателями пожарной опасности газов. Концентрация пара по высоте над зеркалом жидкости в открытом сосуде монотонно уменьшается от 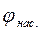 до 0. На характер зависимости не оказывает влияние температура и вид жидкости.
до 0. На характер зависимости не оказывает влияние температура и вид жидкости.
Иначе ведут себя жидкости в закрытом сосуде (рис. 2). В этом случае пары уже не могут рассеиваться в окружающую среду. По мере испарения концентрация пара за время 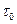 до
до 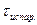 в свободном пространстве сосуда повышается и в итоге достигает состояния насыщения. Устанавливается динамическое равновесие, за время при котором количество испаряющихся молекул жидкости равно количеству молекул пара конденсирующихся обратно в жидкость. Такой пар называют насыщенным, а его парциальное давление - давлением насыщенного пара Рнас.. Как правило, давление насыщенного пара обозначается
в свободном пространстве сосуда повышается и в итоге достигает состояния насыщения. Устанавливается динамическое равновесие, за время при котором количество испаряющихся молекул жидкости равно количеству молекул пара конденсирующихся обратно в жидкость. Такой пар называют насыщенным, а его парциальное давление - давлением насыщенного пара Рнас.. Как правило, давление насыщенного пара обозначается 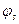 . Концентрация насыщенного пара во всем закрытом объеме одинакова. Зная давление насыщенного пара можно рассчитать его концентрацию в паро-воздушной смеси и установить пожарную опасность смеси насыщенного пара с воздухом.
. Концентрация насыщенного пара во всем закрытом объеме одинакова. Зная давление насыщенного пара можно рассчитать его концентрацию в паро-воздушной смеси и установить пожарную опасность смеси насыщенного пара с воздухом.
Давление насыщенного пара горючих жидкостей часто используется в пожарно-технических расчетах.
Зависимость давления насыщенного пара от температуры описывается уравнением Клапейрона - Клаузиуса:
в дифференциальной форме:
dlnP/dT = Qисп/(RT2), (1)
или в интегральной форме:
Pнас = P0 exp(-Qисп/(RT0), (2)
где Рнас - давление насыщенного пара;
Qисп - мольная теплота испарения жидкости.
Помимо уравнения Клапейрона - Клаузиуса давление насыщенных паров может быть рассчитано по эмпирическому уравнению Антуана:
lgP = А - В/(t + C), (3)
где А,В,С - константы, определяемые эмпирически.
Их можно так же рассчитать по уравнениям, приведенным в монографии В.Т. Монахова "Методы исследования пожарной опасности веществ".
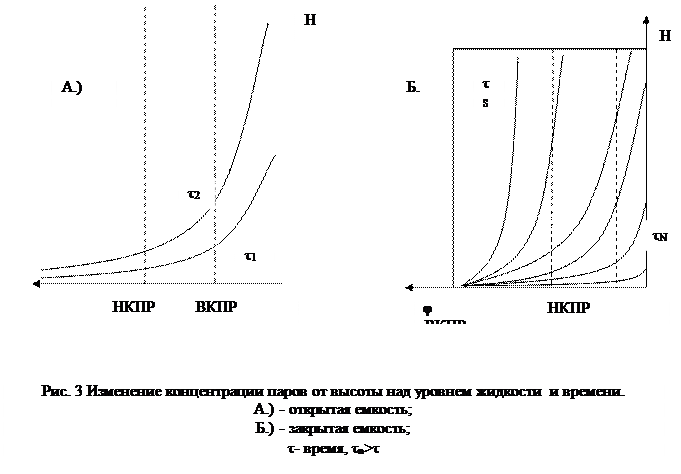
Выражения (1.2) и (1.3) показывают, что парциальное давление насыщенного пара пропорционально температуре жидкости. Графически эта зависимость в общем виде представлена на рис.1.4 (здесь численные значения Рнас пересчитаны на концентрацию пара). На приведенном графике видно, что НКПР и ВКПР пара достигаются при значениях температур: Тн и Тв. Эти температуры называются температурными пределами распространения пламени жидкости, обозначаются ТПР.
| Нижним (НТПР) или верхним (ВТПР) температурным пределом распространения пламени называется температура жидкости, при которой концентрация паров над ее поверхностью равна соответствующему концентрационному пределу. |
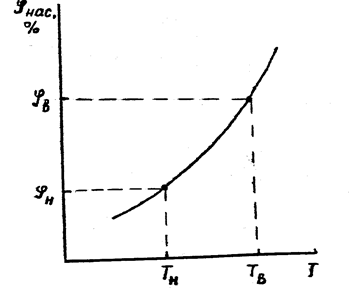
Рис.4. Зависимость концентрации паров
от температуры жидкости
Температурные пределы Тн и Тв связаны с КПР пламени зависимостью:
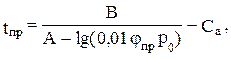 (4)
(4)
где jпр - нижний или верхний КПР, %;
Р0 - атмосферное давление, кПа;
А, В, Са - константы уравнения Антуана для давления насыщенных паров.
Зная давление насыщенного пара жидкости, можно рассчитать и скорость ее испаренияс открытой поверхности:
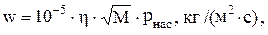 (5)
(5)
где h - коэффициент, учитывающий влияние температуры жидкости и скорости воздушного потока над ее поверхностью;
М - молярная масса вещества;
Рнас - давление нсыщенного пара, кПа.
Таким образом, при нагревании жидкости можно подобрать такую температуру, при которой над ее поверхностью концентрация паров станет равной НКПР, т.е. паро-воздушная смесь становится способной к воспламенению от постороннего источника зажигания. Эксперименты показывают, что при этой температуре сгорают только пары, а жидкость не загорается. Поэтому ее называют температурой вспышки.
Температура вспышки - это наименьшая температура конденсированного вещества, при которой в условиях специальных испытаний над его поверхностью образуются пары и газы, способные вспыхивать от источника зажигания; устойчивое горение при этом не возникает.
При дальнейшем нагревании жидкости можно достичь такой температуры, при которой скорость испарения будет уже достаточной для возникновения самоподдерживающегося процесса горения жидкости после удаления источника зажигания. Такая температура называется температурой воспламенения.
Температура воспламенения - это наименьшая температура вещества, при которой в условиях специальных испытаний вещество выделяет горючие газы и пары с такой скоростью, что при воздействии источника зажигания наблюдается воспламенение жидкости.
Температура воспламенения обычно на 1-30 °С выше температуры вспышки.
Температура вспышки является важнейшим показателем пожарной опасности жидкостей. Применяется при классификации жидкостей по степени пожарной опасности, при категорировании помещений и зданий по взрывной, взрывопожарной и пожарной опасности, а также при определении классов взрывоопасных и пожароопасных зон.
Жидкости с температурой вспышки до 61°С относятся к легковоспламеняющимся (ЛВЖ), а выше 61 °С - к горючим (ГЖ).
Температурные пределы распространения пламени применяются при расчете пожаровзрывобезопасных температурных режимов работы технологического оборудования, при оценке аварийных ситуаций, связанных с разливом жидкостей и для расчетов КПР пламени.
Дата добавления: 2020-02-05; просмотров: 1230;











