Теория атома водорода по Бору
Линейчатый спектр атома водорода
Во второй половине 19 века было проведено детальное исследование спектров газов и паров металлов. Оказалось, что изолированные атомы разряженного газа, паров металлов имеют линейчатые спектры. Спектры состоят из отдельных линий расположенных не беспорядочно. Лини объединяются в группы и серии.
В 1885 году швейцарский физик и математик Бальмер, изучая видимую часть спектра водорода, показал, что длины волн ее удовлетворяют формуле (формула Бальмера):
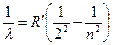 , где
, где 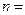 3, 4, 5…,
3, 4, 5…,
Здесь 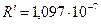
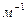 - постоянная Ридберга.
- постоянная Ридберга.
Так как 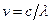 , то формула Бальмера может быть переписана для частот:
, то формула Бальмера может быть переписана для частот:
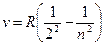 ,
,
где 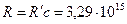
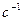 .
.
Совокупность длин волн, удовлетворяющих формуле Бальмера, называется серией Бальмера. Дальнейшие исследования показали, что в спектре водорода есть несколько серий:
Серия Лаймана: 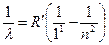 ,
, 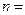 2, 3, 4,…, которая находится в ультрафиолетовой области спектра.
2, 3, 4,…, которая находится в ультрафиолетовой области спектра.
Серия Бальмера: 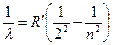 , где
, где 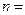 3, 4, 5… - в видимой области спектра.
3, 4, 5… - в видимой области спектра.
В инфракрасной области спектра были обнаружены:
Серия Пашена: 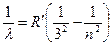 , где
, где 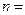 4, 5,6 …
4, 5,6 …
Серия Брекета: 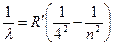 , где
, где 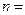 5, 6, 7…
5, 6, 7…
Серия Пфунда: 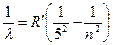 , где
, где 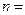 6, 7, 8…
6, 7, 8…
Серия Хэмфри: 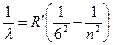 , где
, где 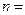 7, 8, 9…
7, 8, 9…
Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
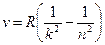 ,
,
где 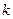 имеет в каждой серии постоянное значение:
имеет в каждой серии постоянное значение: 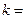 1, 2, 3,…,
1, 2, 3,…, 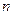 принимает целочисленные значения, начиная с
принимает целочисленные значения, начиная с 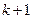 и определяет отдельные линии этой серии:
и определяет отдельные линии этой серии: 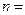
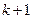 ,
, 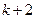 , …,
, …, 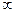 . Значение
. Значение 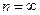 определяет границу серии.
определяет границу серии.
Приведенные выше формулы подобраны эмпирически и долгое время не имели теоретического обоснования.
Модели атома Томсона и Резерфорда
Для объяснения спектров атомов были предложены различные модели атомов.
В 1903 году английский физик Томсон предложил модель атома, представляющую собой непрерывно заряженный положительный шар радиусом 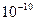 м, в которую вкраплены электроны. Суммарный отрицательный заряд, равен положительному заряду шара и поэтому атом нейтрален.
м, в которую вкраплены электроны. Суммарный отрицательный заряд, равен положительному заряду шара и поэтому атом нейтрален.
Однако, в 1911 году английский физик Резерфорд своими опытами по рассеянию 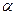 - частиц опровергает утверждение Томсона о непрерывном распределении положительного заряда внутри шара. В своем опыте Резерфорд обнаружил, что при прохождении
- частиц опровергает утверждение Томсона о непрерывном распределении положительного заряда внутри шара. В своем опыте Резерфорд обнаружил, что при прохождении 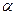 - частиц через золотую фольгу толщиной 1мкм основная их часть испытывает незначительные отклонения, но некоторые
- частиц через золотую фольгу толщиной 1мкм основная их часть испытывает незначительные отклонения, но некоторые 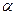 - частицы (примерно одна из 20000) отклоняются на углы равные
- частицы (примерно одна из 20000) отклоняются на углы равные 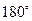 . На основании этих исследований Резерфорд предложил планетарную модель атома. Согласно этой модели в центре атома находится положительно заряженное ядро, имеющие размеры
. На основании этих исследований Резерфорд предложил планетарную модель атома. Согласно этой модели в центре атома находится положительно заряженное ядро, имеющие размеры 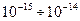 м. Вокруг ядра по орбитам вращаются электроны. Число электронов равно заряду ядра.
м. Вокруг ядра по орбитам вращаются электроны. Число электронов равно заряду ядра.
Столкновение с ядром 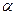 - частиц происходят крайне редко из-за его малых размеров. Но планетарная модель оказалась в противоречии с законами классической механики и электродинамики:
- частиц происходят крайне редко из-за его малых размеров. Но планетарная модель оказалась в противоречии с законами классической механики и электродинамики:
- Вращающийся электрон имеет заряд, движется он ускоренно и поэтому должен излучать. Излучая энергию, он приближается к ядру по спирали. Расчеты показывают, что он упадет на ядро через
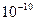 с. То есть атом Резерфорда не устойчив.
с. То есть атом Резерфорда не устойчив. - По мере приближения к ядру радиус траектории электрона убывает. Момент инерции его
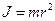 убывает. Но по закону сохранения момента импульса
убывает. Но по закону сохранения момента импульса 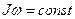 . Так как
. Так как 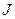 непрерывно убывает,
непрерывно убывает, 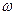 должно расти. Поэтому спектр излучения должен быть сплошным, а не линейчатым.
должно расти. Поэтому спектр излучения должен быть сплошным, а не линейчатым.
Таким образом, планетарная модель атома не могла объяснить ни устойчивость атома, ни характер спектра.
Постулаты Бора
Для того, чтобы объяснить линейчатые спектры атомов датский физик Нильс Бор в 1913 году вводит два постулата.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся во времени) состояния, в которых он не излучает энергию. Энергии этих состояний образуют дискретный ряд: 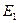 ,
, 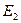 , …,
, …, 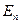 . Стационарным состояниям атома соответствуют орбиты, по которым движутся электроны. Хотя электроны движутся по стационарным орбитам с ускорением, они не излучают и не поглощают энергию.
. Стационарным состояниям атома соответствуют орбиты, по которым движутся электроны. Хотя электроны движутся по стационарным орбитам с ускорением, они не излучают и не поглощают энергию.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные значения момента импульса, удовлетворяющие условию:
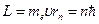 ,
, 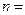 1, 2, 3,…,
1, 2, 3,…,
где 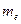 - масса электрона,
- масса электрона, 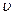 - его скорость по
- его скорость по 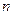 -ой орбите радиуса
-ой орбите радиуса 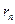 ,
, 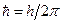 .
.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) квант с энергией:
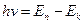 .
.
При 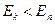 происходит излучение фотона (переход из состояния с большей энергией в состояние с меньшей энергией), при
происходит излучение фотона (переход из состояния с большей энергией в состояние с меньшей энергией), при 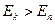 - поглощение фотона (переход атома в состояние с большей энергией).
- поглощение фотона (переход атома в состояние с большей энергией).
Набор возможных дискретных частот 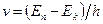 определяет линейчатый спектр атома.
определяет линейчатый спектр атома.
Спектр атома водорода по Бору
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем, состоящих из ядра с зарядом 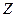 и одного электрона (ионы
и одного электрона (ионы 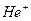 ,
, 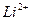 ), а также теоретически вычислить постоянную Ридберга.
), а также теоретически вычислить постоянную Ридберга.
Рассмотрим движение электрона в водородоподобной системе по стационарным круговым орбитам.
Решая совместно уравнение 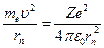 , вытекающие из планетарной модели Резерфорда, и уравнение для момента импульса стационарных орбит
, вытекающие из планетарной модели Резерфорда, и уравнение для момента импульса стационарных орбит 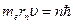 , получим выражение для радиуса
, получим выражение для радиуса 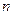 -ой стационарной орбиты. Помножим правую и левую часть первого уравнения на
-ой стационарной орбиты. Помножим правую и левую часть первого уравнения на 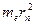 :
:
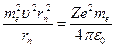 .
.
Возведем обе части второго уравнения 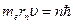 , в квадрат:
, в квадрат:
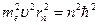 .
.
Из этих уравнений можно выразить значение радиуса:
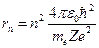 ,
, 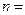 1, 2, 3, …
1, 2, 3, …
Из этого выражения следует, что радиусы орбит растут пропорционально квадрату целых чисел. Для водорода ( 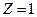 ) радиус первой электронной орбиты (
) радиус первой электронной орбиты ( 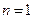 ) равен:
) равен:
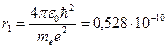 м,
м,
что соответствует размерам атома, рассчитанным из молекулярно-кинетической теории газов.
Теперь подсчитаем полную энергию электронов, находящихся на стационарных орбитах. Полная энергия электрона складывается из его кинетической энергии 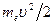 и потенциальной энергии в электростатическом поле ядра
и потенциальной энергии в электростатическом поле ядра 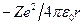 :
:
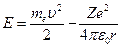 .
.
Учитывая уравнение 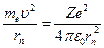 и выражение для радиуса
и выражение для радиуса 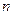 -ой орбиты
-ой орбиты 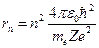 , получим выражение для полной энергии в виде:
, получим выражение для полной энергии в виде: 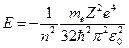 .
.
Учитывая, что 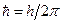 , окончательно получим:
, окончательно получим:
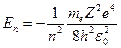 .
.
Энергетические состояния атома образуют последовательность энергетических уровней, меняющихся в зависимости от значения 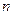 . Число
. Число 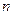 , определяющее энергетические уровни атома, называется главным квантовым числом. Состояние с
, определяющее энергетические уровни атома, называется главным квантовым числом. Состояние с 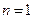 называется основным, состояния с
называется основным, состояния с 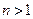 - возбужденными. Придавая
- возбужденными. Придавая 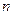 различные целочисленные значения, получим для атома водорода (
различные целочисленные значения, получим для атома водорода ( 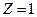 ) возможные уровни энергии.
) возможные уровни энергии.
Энергия атома водорода с увеличением 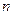 возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются с границе, соответствующей значению
возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются с границе, соответствующей значению 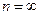 . Минимальная энергия атома водорода равна
. Минимальная энергия атома водорода равна 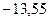 эВ при
эВ при 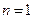 , максимальная энергия равна нулю при
, максимальная энергия равна нулю при 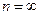 . Значение
. Значение 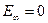 соответствует ионизации атома (отрыву от него электрона).
соответствует ионизации атома (отрыву от него электрона).
Согласно второму постулату Бора при переходе атома водорода из стационарного состояния 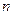 в состояние с меньшей энергией
в состояние с меньшей энергией 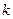 испускается квант с энергией:
испускается квант с энергией:
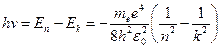 .
.
Откуда частота излучения равна:
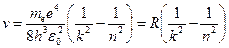 ,
,
где 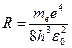 .
.
Величина 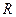 , рассчитанная по этой формуле, совпала с экспериментальным значением постоянной Ридберга в эмпирической формуле для атома водорода.
, рассчитанная по этой формуле, совпала с экспериментальным значением постоянной Ридберга в эмпирической формуле для атома водорода.
Подставляя 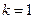 и
и 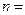 2, 3, 4,… получаем серию Лаймана (переходы с возбужденных уровней
2, 3, 4,… получаем серию Лаймана (переходы с возбужденных уровней 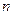 на основной
на основной 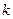 ). При подстановке
). При подстановке 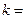 2, 3, 4, 5, 6 и соответствующих им значений
2, 3, 4, 5, 6 и соответствующих им значений 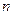 получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри.
получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри.
Спектр поглощения атома водорода является также линейчатым, но содержит только серию Лаймана. Так как свободные атомы водорода находятся в основном состоянии, то при сообщении атомам энергии извне могут наблюдаться лишь переходы из основного состояния в возбужденные.
Таким образом, теория Бора позволила вычислить частоты спектральных линий атома водорода и водородоподобных систем, но не могла объяснить их интенсивности и почему вероятность различных переходов разная. Теория Бора не смогла объяснить спектр атома гелия, содержащего два электрона в поле ядра. Теория Бора содержит внутренние противоречия: она основывается на классической физике, но вводит квантовые постулаты. Теория Бора является переходной от классической физики к квантовой.
| <== предыдущая лекция | | | следующая лекция ==> |
| Элементы геометрической оптики. | | | Элементы квантовой механики |
Дата добавления: 2016-05-28; просмотров: 4479;











