Препараты на основе очищенных продуктов метаболизма микроорганизмов (витамины, аминокислоты, ферменты, антибиотики и др.)
Виды продуктов микробиологического синтеза
Микробиологический синтез — промышленный способ получения химических соединений и продуктов (например, кормовых дрожжей), осуществляемый благодаря жизнедеятельности размножающихся микробных клеток.
Некоторые продукты микробиологического синтеза, например, пекарские дрожжи, давно использовались человеком, однако широкое применение микробиологического синтеза началось в 40-50-х гг. 20 в. в связи с освоением производства пенициллина. К этому же времени относится возникновение новой отрасли народного хозяйства - микробиологической промышленности.
Клетки животных и растений, микробные клетки в процессе жизнедеятельности (ассимиляции и диссимиляции) образуют новые продукты и выделяют метаболиты, обладающие разнообразными физико-химическими свойствами и биологическим действием. Обычно продукты жизнедеятельности одноклеточных делят на 4 категории:
- сами клетки как источник целевого продукта. Например, выращенные бактерии или вирусы используют для получения живой или убитой корпускулярной вакцины; дрожжи – как кормовой белок или основу для получения гидролизатов питательных сред и т.д.;
- крупные молекулы (макромолекулы), которые синтезируются клетками в процессе выращивания: ферменты, токсины, антигены, антитела, пептидогликаны и др.;
- первичные метаболиты – низкомолекулярные вещества, необходимые для роста клеток (аминокислоты, витамины, нуклеотиды, органические кислоты);
- вторичные метаболиты (идиолиты) – низкомолекулярные соединения, не требующиеся для роста клеток (антибиотики, алкалоиды, токсины, гормоны).
Препараты на основе очищенных продуктов метаболизма микроорганизмов (витамины, аминокислоты, ферменты, антибиотики и др.)
Антибиотики. Большинство антибиотиков накапливается вне клеток микроорганизма-продуцента, которыми в основном являются актиномицеты, некоторые грибы и бактерии (в основном их мутантные формы). Антибиотики, употребляемые в медицине, подвергаются высокой степени очистки.
В основе промышленного производства антибиотиков лежит ряд последовательных этапов: получение высокопродуктивных штаммов-продуцентов, разработка наиболее благоприятных условий культивирования продуцента антибиотика с максимальным биосинтезом этого вещества, подбор и внедрение в практику соответствующих методов выделения и очистки антибиотика, создание готовых препаратов и контроль их качества. Каждый из этих этапов должен обеспечиваться соответствующими специалистами (генетиками, микробиологами, технологами и др.).
Промышленный способ получения антибиотиков — сложный многоступенчатый процесс, включающий ряд технологических стадий. Ниже мы рассмотрим из них основные.
Подготовка среды для культивирования продуцента антибиотика и посевного материала (1 стадия). Подготовка среды. Для каждого продуцента антибиотика, для каждого вновь полученного штамма разрабатывается своя оптимальная среда, которая должна отвечать следующим основным требованиям: а) обеспечивать хороший рост продуцента и максимально возможное образование антибиотика, б) содержать доступные и дешевые компоненты, в) обладать хорошей фильтрующей способностью, г) обеспечивать применение наиболее экономичных и эффективных приемов выделения и очистки антибиотика. Стерилизация питательных сред в промышленных условиях осуществляется двумя основными методами: периодическим и непрерывным.
Периодический метод стерилизации применяется при использовании небольших объемов среды и состоит в том, что среда нагревается до определенной температуры (120—130°С) непосредственно в ферментерах или в специальных котлах-стерилизаторах, выдерживается при этой температуре в течение 30— 60 мин (в зависимости от объема среды и ее состава), после чего среда охлаждается до 27—30°С.
Непрерывный метод стерилизации целесообразно применять при использовании больших объемов среды. Приготовленная среда из специального сосуда с помощью насоса подастся в стерилизационную колонку, через которую пропускается острый пар (давление пара около 5 атм.). Пар подается сверху по внутренней трубе, имеющей щелевидиые прорези, благодаря чему пар поступает в среду и быстро ее нагревает. Среда в колонку подается снизу и движется по спирали вокруг внутренней трубы.
Нагретая в колонке до необходимой для стерилизации температуры (около 130°С) среда поступает в специальный аппарат— выдерживатель, где она при температуре 125—130°С выдерживается определенное время. Время выдержки зависит от состава среды и составляет 5—10 мин. Из выдерживателя стерильная среда поступает в змеевиковый холодильник. Здесь она охлаждается до 30—35°С (на выходе) и поступает в ферментер.
Непрерывный метод стерилизации имеет ряд преимуществ перед периодическим методом: возможность автоматического регулирования процесса, быстрый и равномерный нагрев среды, обеспечение более полной стерильности среды и другие факторы.
Подготовка посевного материала — одна из ответственнейших операций в цикле биологического метода получения антибиотиков. Количество и качество посевного материала определяют развитие культуры в ферментере и биосинтез антибиотика. Продуцент антибиотика обычно выращивается на богатых по составу средах, способных обеспечить наивысшую физиологическую активность микроорганизмов.
Биосинтез антибиотика (2-я стадия). Стадия биосинтеза — основная биологическая стадия в процессе получения антибиотика. Ее призваны вести и контролировать высококвалифицированные микробиологи.
Задача этой стадии — обеспечение для продуцента антибиотика таких условий развития, которые бы способствовали максимальному уровню биосинтеза антибиотика.
Эффективность стадии биосинтеза зависит от уровня образования антибиотика организмом: определяется генетическими особенностями организма, составом питательной среды, режимом развития продуцента. Она также зависит от времени максимального образования антибиотического вещества, стоимости компонентов среды, включая стоимость предшественника, иепогасителей, энергетических затрат, связанных с процессом развития организма-продуцента антибиотика. В энергетические затраты включаются расходы энергии (и ее стоимость), связанные со стерилизацией среды, ферментера и коммуникаций, с перемешиванием культуральиой жидкости, продуванием воздуха через нее, и другие процессы.
В современных условиях развития промышленной микробиологии наиболее перспективным методом выращивания микроорганизмов-продуцентов антибиотиков или других биологически активных соединений является метод глубинного культивирования. При производстве антибиотиков используют периодическое и непрерывное культивирование продуцентов этих биологически активных веществ.
Ферментеры. Для получения антибиотиков в промышленных масштабах применяются специальные герметически закрытые емкости или ферментеры, обеспечивающие глубинное выращивание продуцентов.
Ферментер — это довольно сложный аппарат, обеспечивающий хорошие условия для глубинного развития продуцента и биосинтеза им антибиотика: снабжен приспособлениями для достаточной аэрации и перемешивания культуры, поддержания необходимой температуры, а также контрольно-измерительными приборами (рис. 5.1). В последнее время выпускаются ферментеры с автоматизированной системой контроля.
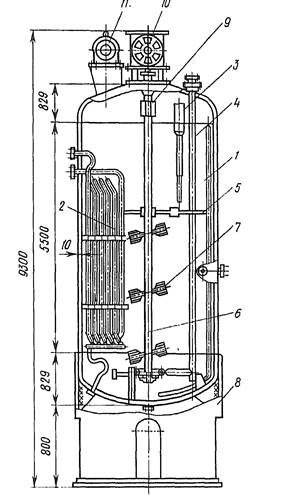
Рисунок 5.1 – Ферментер для глубинного выращивания продуцентов антибиотиков: 1 – корпус аппарата, 2 – теплообменник, 3 – гильза для термометра, 4 – барботер, 5 – растяжки для центровки вала, 6 – вал мешалки, 7 – лопасть мешалки, 8 – стойка ферментера, 9 – соединительная муфта вала, 10 – привод мешалки, 11 – мотор
Аэрирование культуры в ферментере происходит в результате подачи подогретого до необходимой температуры стерильного воздуха через специальные приспособления — барботеры, а также благодаря перемешиванию культуральной жидкости различного типа мешалками (пропеллерными, турбинными и др.) и наличию отбойников. В последнее время при производстве антибиотиков испытывают низкочастотное вибрационное перемещение культуральной жидкости как наиболее экономичный способ.
Поддержание температуры, оптимальной для хорошего роста продуцента антибиотика и проявления им повышенной физиолого-биохимической активности, обеспечивается рубашкой ферментера или системой змеевиков. Змеевики используются также для подачи пара в процессе стерилизации или воды для охлаждения.
Наблюдение за основными процессами жизнедеятельности организма осуществляется контрольно-измерительной аппаратурой, позволяющей регулировать скорость перемешивания культуральной среды, поддерживать на заданном уровне температуру внутри ферментера, рН среды, количество пропускаемого воздуха, давление внутри ферментера и другие параметры. Применяются установки, позволяющие автоматически определять содержание азота в среде по ходу развития организма. Ферментеры снабжены приспособлениями для переноса инокулята, внесения дополнительных питательных веществ, необходимых для лучшего развития культуры, пеногасителя и устройством для взятия проб.
В промышленных условиях получения антибиотиков применяют ферментеры различной емкости — от 500 л до 50, 100 м3 и более. Стерилизацию, производственных ферментеров, а также всех обслуживающих их коммуникаций проводят перегретым паром. Воздух, необходимый для аэрации, стерилизуется через специальные фильтры, заполненные стеклянной ватой или активированным древесным углем.
Подготовка посевного материала — процесс многоступенчатый. Микроорганизм предварительно выращивают на авизированной среде в пробирке, затем из пробирки высевают в колбы с жидкой питательной средой и проводят две генерации при глубинном выращивании на качалках в течение 2—3 суток для каждой генерации. Из второй генерации культуры (в колбе) делают посев в небольшой (10 л) инокулятор, а затем хорошо развившуюся культуру переносят в более крупный инокулятор (100— 500 л), откуда и производят посев в основной ферментер. Для посева в основной ферментер используют от 5 до 10 объемных процентов посевного материала (инокулята).
Развитие организма-продуцента антибиотика в ферментерах.Процесс развития микроорганизма в ферментерах проходит при строгом контроле всех стадий, очень точном выполнении разработанного регламента условий развития организма-продуцента антибиотика. Большое внимание уделяется поддержанию заданной температуры культивирования, активной кислотности среды рН, степени аэрации и скорости работы мешалки. Учитывается потребление организмом основных питательных компонентов субстрата (источников углерода, азота, фосфора), внимательно контролируется образование антибиотика.
Особое внимание при развитии продуцента в ферментерах обращают на процесс пеногашения. При продувании воздуха через культуру микроорганизма часто происходит обильное образование пены, которая существенно нарушает протекание всего процесса развития продуцента антибиотика в ферментере. Основная причина появления большого количества пены — наличие белковых веществ в среде и ее высокая вязкость, обусловленная обильным накоплением биомассы.
Для борьбы с пеной в ферментерах при антибиотикообразовании используют различные поверхностно-активные вещества: растительные масла (соевое, подсолнечное), животный жир (лярд, кашалотовый жир), а иногда минеральные масла (вазелиновое, парафиновое), спирты и высшие жирные кислоты. Нередко в качестве пеногасителеи используют специально синтезированные вещества (силиконы, диазобуталкарбомил и другие соединения).
Предварительная обработка культуральной жидкости (3-я стадия).В процессе развития микроорганизмов-продуцентов антибиотиков эти вещества в большинстве случаев почти полностью выделяются из клеток в окружающую среду. Однако в некоторых случаях лишь часть антибиотика выделяется в культуральную жидкость, а другая часть сохраняется внутри клеток. У ряда продуцентов антибиотик почти полностью содержится в клетках организма.
В зависимости от того, где антибиотическое вещество сосредоточено, применяют соответствующие методы его извлечения. Так, если антибиотик находится в культуральной жидкости, его выделяют методами экстракции растворителями, не смешивающимися с жидкой фазой, или осаждают в виде нерастворимого соединения, или сорбируют ионообменными смолами.
Выделение антибиотика из клеток микроорганизмов осуществляют с помощью экстракции органическими растворителями. Если антибиотик содержится в культуральной жидкости и в клетках продуцента, первичной операцией его выделения является перевод антибиотика в фазу, из которой наиболее целесообразно его изолировать. Для этого антибиотик, содержащийся в культуральной жидкости, и клетки с антибиотическим веществом переводят в осадок, а затем антибиотик экстрагируют.
Отделение нативного раствора от биомассы и взвешенных частиц проводят методами фильтрации или центрифугирования. При этом применяют меры для обеспечения лучшей фильтруемости культуральной жидкости (кислотную или тепловую коагуляцию, обработку электролитами, внесение различных добавок и т. п.). Для процесса фильтрации применяют различные фильтрующие аппараты: фильтр-пресс, нутч-фильтр, друк-фильтр, центрифуги, сепараторы.
Фильтр-прессы применяются для обработки больших объемов культуральной жидкости. Эти аппараты состоят из ряда чередующихся плит и рам и фильтрующих перегородок между ними. Процесс фильтрации осуществляется под давлением.
Для фильтрации небольших объемов культуральной жидкости обычно используют нутч-фильтры или друк-фильтры. Первый аппарат работает под вакуумом, второй — в условиях повышенного давления над фильтрующейся жидкостью.
Для получения жидкости, освобожденной от взвешенных частиц, широкое распространение нашел способ центрифугирования. Хорошие результаты достигаются при правильном выборе скорости подачи жидкости (лучший вариант—15000 об/мин). Отделение мицелия или других взвешенных частиц может также происходить в сепараторах. При скорости вращения барабана сепаратора, равной 7000—7500 об/мин, благодаря центробежной силе твердые частицы устремляются к стенкам барабана и осаждаются там, а отсепарированная жидкость стремится к центру барабана и поднимается в специальную камеру.
Выделение и очистка антибиотика (4-я стадия). В процессе образования антибиотика в культуральную жидкость наряду с присутствием в ней различных неиспользованных компонентов среды выделяются и разнообразные продукты обмена, она обогащается продуктами автолиза клеток. Удаление примесей — первая и весьма важная стадия химической очистки антибиотика.
Стадия выделения и химической очистки включает ряд процессов: от обработки нативного раствора до сушки готового очищенного препарата. На этой стадии в зависимости от свойств антибиотика, его химического строения и места основного накопления применяют различные методы выделения и очистки. В качестве основных методов используют экстракцию, осаждение, сорбцию на ионообменных материалах, упаривание, сушку.
Одной из особенностей стадии выделения и химической очистки является то, что при выделении антибиотиков приходится работать с весьма невысокими концентрациями выделяемого вещества (не превышающими одного процента). В конце стадии химической очистки уже имеют дело с более высокими концентрациями антибиотика, достигающими 20—30%.
Цель химической очистки — извлечение антибиотика из нативной жидкости или из клеток продуцента, концентрация его и освобождение (собственно очистка) от сопутствующих примесей и в конечном счете получение высоко очищенного препарата, пригодного для соответствующего применения.
Антибиотические вещества под влиянием жестких внешних факторов (повышенная температура, высокая кислотность или щелочность и др.) в ряде случаев теряют свои свойства, инактивируются. Поэтому при их выделении и очистке необходимо соблюдать максимум осторожности.
Метод экстракции. Нередко в целях очистки антибиотика от различных примесей его многократно переводят из одного растворителя в другой с предварительным осаждением (кристаллизацией). Такой прием носит название перекристаллизации.
Ионообменная сорбция. Метод состоит в том, что при пропускании водных растворов антибиотиков, являющихся по химической природе кислотами, основаниями или амфотерными соединениями, через колонки с соответствующими ионообменными смолами они сорбируются на них, а раствор с частью примесей, имеющих противоположный антибиотику заряд, проходит через колонку. Смолы в зависимости от положительного или отрицательного заряда иона в них называют катионидами или анионидами. Антибиотик в виде отрицательно заряженного иона будет сорбироваться на катиоиидной смоле, и наоборот. Адсорбированный на смоле антибиотик элюируют (десорбируют), в результате чего получают значительно очищенный и сконцентрированный препарат. Затем раствор препарата можно вновь пропустить через ионообменную смолу, но имеющую противоположный заряд. При этом примеси осядут на смоле, а раствор более очищенного антибиотика пройдет через колонку.
Метод осаждения основан на том, что антибиотик связывают с органическими или неорганическими веществами с целью получения соединения, выпадающего в осадок. Полученный осадок с помощью фильтров или центрифугирования отделяют от нативного раствора, промывают и в ряде случаев высушивают, после чего образовавшееся соединение разлагают и антибиотик экстрагируют или вновь осаждают (кристаллизуют).
Одной из стадий химической очистки антибиотиков является концентрирование полученных растворов путем отгонки большей части растворителя, как правило, в высоком вакууме.
Применяемые методы выделения и химической очистки, а также качество оборудования и используемых реактивов имеют большое значение прежде всего для улучшения качества получаемого антибиотика и для увеличения его выхода.
Получение готовой продукции, приготовление лекарственных форм, расфасовка (5-я стадия).Известно, что к антибиотикам, используемым в медицинской практике, предъявляются очень высокие требования (высокая степень очистки, стерильность препарата и др.). Поэтому на указанной стадии работы, а также при химической очистке препарата необходимо соблюдать высокую степень чистоты на всех операциях. Для этого поддерживают в исключительной чистоте не только используемое оборудование, но и помещение, где производят работу.
Антибиотики, предназначенные для инъекций, должны быть стерильными. Поэтому получение таких препаратов, приготовление различных лекарственных форм, расфасовка и упаковка осуществляются в асептических условиях.
После выделения и химической очистки антибиотика его необходимо высушить — удалить из полученного препарата свободную и связанную воду. Поскольку большинство антибиотиков в той или иной степени термолабильиы, для их высушивания необходимо применять методы, не приводящие к потере биологической активности и не изменяющие цвета препарата.
На современном этапе промышленного получения антибиотиков используют различные методы обезвоживания препаратов.
Широкое распространение получила лиофильная сушка антибиотиков, которая проводится при сравнительно низких температурах (-8, -12°С).
Прогрессивным методом при работе с большими количествами антибиотика является высушивание с применением распылительной сушилки. Раствор антибиотика пневматически распыляется до мельчайших капель в камере потоком нагретого воздуха. Процесс высушивания антибиотиков протекает в течение нескольких секунд. При этом даже термолабильные препараты не меняют своих свойств.
Сушка зернистых и пастообразных антибиотических препаратов производится в вакуум-сушильных шкафах или методом взвешенного слоя.
Готовый антибиотик подвергается тщательному биологическому и фармакологическому контролю.
Витамины, провитамин, коферменты. Методом микробиологического синтеза производят в основном витамин В12 и его коферментную форму. Продуцентами в этом процессе служат пропионовокислые бактерии. Для получения кормовых концентратов, содержащих витамин В12, на отходах бродильной промышленности (послеспиртовые, ацетоно-бутиловые барды и др.) применяют комплекс метанообразующих бактерий. Разработаны способы получения витамина В2, р-каротина и дрожжей, обогащенных эргостеринами..
Получение и применение витамина B12.Мировая продукция витамина В12 составляет 9—11 тыс. кг в год; из них 6500 кг используют на медицинские цели, а остальную часть — для животноводства. Производство витамина В12 основано главным образом на культивировании пропионовокислых бактерий, мезофильных и термофильных меганогенных бактерий, а также актиномицетов и родственных форм.
Для получения витамина В12 бактерии культивируют периодическим методом в анаэробных условиях в среде, содержащей кукурузный экстракт, глюкозу, соли кобальта и сульфат аммония. Образующиеся в процессе брожения кислоты нейтрализуют раствором щелочи, которая непрерывно поступает в ферментер. Через 72 ч в среду вносят предшественник — 5,6-ДМБ. Без искусственного введения 5,6-ДМБ бактерии синтезируют фактор В и псевдовитамин В12 (азотистым основанием служит аденин), не имеющие клинического значения.
Ферментацию заканчивают через 72 ч. Витамин В12 сохраняется в клетках бактерий. Поэтому после окончания брожения биомассу сепарируют и экстрагируют из нее витамин водой, подкисленной до рН 4,5—5,0 при 85—90 °С в течение 60 мин с добавлением в качестве стабилизатора 0,25 %-ной NaNО2. При получении Кo-В12 стабилизатор не добавляют.
Водный раствор витамина В12 охлаждают, доводят рН до 6,8—7,0 50 %-ным раствором NaOH. К раствору добавляют Al2(SO4)3xI8H2O и безводный FeCl3 для коагуляции белков и фильтруют через фильтр-пресс.
Очистку раствора проводят на ионообменной смоле СГ-1, с которой кобаламины элюируют раствором аммиака. Далее проводят дополнительную очистку водного раствора витамина органическими растворителями, упаривание и очистку на колонке с А12O3. С окиси алюминия кобаламины элюируют водным ацетоном. При этом Кo-В12 может быть отделен от CN- и оксикобаламина.
К водно-ацетоновому раствору витамина добавляют ацетон и выдерживают при 3—4°С 24—48 ч. Выпадающие кристаллы витамина отфильтровывают, промывают сухим ацетоном и серным эфиром и сушат в вакуум-эксикаторе над Р2О5. Для предотвращения разложения Ко-В12 все операции необходимо проводить в сильно затемненных помещениях или при красном свете. Таким образом, можно получить не только смесь CN- и оксикобаламинов, но и коферментную форму, которая обладает высоким терапевтическим эффектом.
Для химической очистки витамина В12 используется его способность образовывать аддукты с фенолом и резорцином. При этом способе отделение витамина В12 от сопутствующих ему факторов упрощается. Промышленный концентрат цианoкобаламина обрабатывают водным раствором резорцина (или фенола), выделяют комплекс витамина В12 с резорцином (или фенолом), далее разлагают его и получают кристаллический препарат.
Аминокислоты. Существенное преимущество микробиологического синтеза аминокислот - возможность их получения в виде природных изомеров (L-форм). Продуцентами аминокислот служат в основном мутанты, лишенные ряда ферментных систем, благодаря чему происходит сверхсинтез необходимого продукта. Обычно используют бактерии, относящиеся к роду Brevibacterium. Больше всего среди аминокислот, вырабатываемых мировой промышленностью, занимают лизин и глутаминовая кислота..
Дата добавления: 2018-11-26; просмотров: 1575;











