Условия стеклообразования, определяемые природой исходных веществ
Наиболее обширные сведения получены для оксидных систем. Исторически сложились два подхода к выработке критериев стеклообразования:
- химический (кристаллохимический);
- термодинамический (энергетический).
Первые обобщения были высказаны норвежским ученым, кристаллохимиком В.М.Гольдшмидтом в 1926 году. Он обнаружил, что хорошо стеклующиеся оксиды SiO2, GeO2, P2O5 содержат в кристаллическом состоянии тетраэдры. Следовательно, по мнению Гольдшмидта, присутствие элементарных структурных единиц в виде тетраэдров - это и есть критерий способности стеклообразования.
Это утверждение можно дополнить правилом радиусов Полинга. Известно, что если соотношение размеров катиона и аниона меняется в пределах  , то к.ч.= 4. Поэтому априори становится возможным подбирать состав стекла, зная ионные радиусы исходных компонентов. В дальнейшем выяснилось, что предложенный подход не является универсальным.
, то к.ч.= 4. Поэтому априори становится возможным подбирать состав стекла, зная ионные радиусы исходных компонентов. В дальнейшем выяснилось, что предложенный подход не является универсальным.
Оказалось, что для оксида BeO названный критерий выполняется, однако оксид бериллия не удаётся получить в стеклообразном виде. На это обратил внимание в 1932 году В.Захариасен. Он считал, что атомы в стёклах должны быть увязаны в единую неправильную трёхмерную сетку. В.Захариасен показал, что для образования единой трехмерной сетки, характерной для структуры стекла, должны выполняться пять условий:
1. Внутренняя энергия вещества в стеклообразном состоянии должна быть немного больше внутренней энергии кристаллического состояния, то есть тепловой эффект расстекловывания должен быть небольшим;
2. Каждый атом кислорода в структуре стекла должен быть связан не более чем с двумя катионами;
3. Координационное число катионов в кислородных полиэдрах должно быть небольшим (не более 4);
4. Каждый многогранник должен быть связан с соседними, по крайней мере, тремя общими вершинами;
5. Кислородные многогранники должны связываться между собой таким образом, чтобы возникала трехмерная пространственная сетка.
Эти правила позволяют разделить все простые оксиды на две группы:
1. Стеклообразующие
2. Нестеклообразующие.
Оксиды RO2 и R2O5 в полной мере отвечают указанным критериям стеклования. Такие оксиды называют стеклообразующими.
Оксиды R2O и RO не удовлетворяют названным требованиям, они являются нестеклообразующими;
Для оксидов R2O3 стеклообразование имеет место, если атомы кислорода формируют около атома металла треугольник (например, B2O3).
Оксиды нестеклообразователи делят на две группы:
1. Оксиды модификаторы, видоизменяющие структурную сетку стекла;
2. Промежуточные оксиды, которые сами по себе не способны образовывать стекло, однако в сочетании с другими оксидами они обладают такой способностью (это Al2O3 и BeO).
Понятия стеклообразователь, модификатор и промежуточный оксид разными исследователями определяются по различным критериям. Эти критерии в той или иной степени характеризуют способность оксидов к стеклообразованию. В частности, такое деление оксидов было проведено на основе сопоставления энергетических характеристик атомов и их соединений.
Изучили напряженность ионного поля около различных катионов. Рассчитали соотношение:
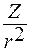 , где Z – заряд иона; r – ионный радиус.
, где Z – заряд иона; r – ионный радиус.
Это мера электростатической силы, с которой катион действует на соседние анионы кислорода (табл. 1.7).
Таблица 1.7
Энергетические характеристики ионов.
| Вид оксидов | Катионы | К.ч. | Ионный радиус, Нм | Напряженность поля,Z/ r2 | Энергия диссоциации оксида, кДж/моль | Единичная сила связи кДж/моль |
| Стеклообразователи | B3+ | 0,020 | 75,0 | |||
| P5+ | 0,034 | 43,2 | 463-369 | |||
| Si4+ | 0,041 | 23,8 | ||||
| Ge4+ | 0,053 | 14,2 | ||||
| As5+ | 0,047 | 22,6 | 364-293 | |||
| Промежуточные | Be2+ | 0,031 | 20,8 | |||
| Al3+ | 0,050 | 12,0 | 1328-1684 | 222-281 | ||
| Ti4+ | 0,068 | 8,7 | ||||
| Zr4+ | 0,080 | 6,3 | ||||
| Модификаторы | Mg2+ | 0,065 | 4,7 | |||
| Li+ | 0,060 | 2,78 | ||||
| Ca2+ | 0,099 | 2,04 | ||||
| Na+ | 0,095 | 1,11 | ||||
| Ba2+ | 0,135 | 1,10 | ||||
| K+ | 0,133 | 0,57 |
Стеклообразующим катионам присуща большая напряженность поля, модифицирующие катионы создают слабые поля. Примерно в таком же порядке, который определяется значением напряжённости поля катионов, расположены катионы по их стеклообразующей способности. Однако, указанный критерий нельзя назвать абсолютным, так как имеются исключения в последовательности его изменения при переходе от стеклообразователей к модификаторам.
Способность к стеклованию более корректно определяется силой отдельных связей. Единичная сила связи – это энергия диссоциации оксида, делённая на координационное число катиона. Единичная сила связи последовательно уменьшается при переходе от стеклообразователей к модификаторам.
Для стеклообразователей единичная энергия связи катионов металлов с анионами кислорода больше 335 кДж/моль, для модификаторов эта энергия меньше 250 кДж/моль. Промежуточные оксиды характеризуются энергией связи от 250 до 335 кДж/моль.
Ряд исследователей классифицировали способность элементов к стеклообразованию исходя из их положения в таблице Д.И.Менделеева. Для оксидных стёкол такой анализ провел Стенвеорт. Более широкие обобщения сделала Н.Винтер-Кляйн.
В частности, она отметила, что при образовании сетки стекла возникают межатомные связи с участием р-электронов.
VI группа: O, S, Se, Te s2p4
V группа: N, P, As, Sb, Bi s2p3
IV группа: C, Si, Ge, Sn, Pb s2p2
III группа: B, Al, Ga, In, Tl s2p
Большая группа элементов способна образовывать стеклообразную сетку с участием собственных р-электронов. Если атомы не имеют внешних р-электронов, они могут входить в структурную сетку стекла только в возбужденном состоянии, изменяющим структуру их внешней электронной оболочки. Это элементы первой и второй группы, а также переходные металлы.
Кокорина, обобщая обнаруженные закономерности, выявила три достаточных и необходимых условия стеклообразования:
1. Наличие в структуре локализованных парноэлектронных связей;
2. Построение основной структурной сетки из полимерных комплексов;
3. Соединение соседних комплексов только через одну мостиковую связь.
Под стеклообразной структурой понимается бесконечная сетка из одно-, двух- и трёхмерных комплексов, соединённых локализованными парноэлектронными связями.
Дата добавления: 2018-11-26; просмотров: 1252;











