Химическая стойкость
По своей природе нитраты целлюлозы относительно нестойкие соединения. Для них характерно самопроизвольное химическое разложение даже при умеренных температурах. С повышением температуры скорость разложения увеличивается. Поэтому в пороховой промышленности под химической стойкостью нитроцеллюлозы понимается их способность сопротивляться разложению.
Разложение нитратов целлюлозы заключается в их распаде с выделением различных продуктов (оксидов азота, оксидов углерода, воды и др.). Продукты разложения химически активны, они реагируют между собой и с нитратами целлюлозы. Газообразные продукты распада NO2, NO, пары воды и азотной кислоты являются катализаторами процесса разложения. В результате их действия процесс разложения ускоряется. Наиболее активную роль в этом процессе играет диоксид азота NO2. Он действует как за счет непосредственного окисления нитрата целлюлозы, восстанавливаясь при этом до NO, а последний, окисляясь, дает снова NO2, так и за счет образования неорганических кислот, способствующих протеканию гидролиза.
Суммарный процесс распада нитратов целлюлозы является экзотермическим. Прогрессивное повышение температуры при высоких скоростях распада может привести к самовоспламенению и горению нитратов целлюлозы.
Воздействие внешних условий (тепла, влаги и т.д.) способствует снижению химической стойкости нитратов целлюлозы. Особенно сильно на химическую стойкость влияет содержание в них серной кислоты как связанной, так и свободной. Связанная серная кислота находится в виде смешанных серно-азотных эфиров. Свободную серную кислоту, находящуюся внутри волокон, называют «закапсюлированной» кислотой.
Снижают химическую стойкость нитратов целлюлозы также присутствующие и образующиеся при нитрации нестойкие примеси и побочные вещества, например, нитропродукты гидролиза и окисления целлюлозы (нитросахара). Поэтому при изготовлении нитратов целлюлозы требуется технологическая операция – стабилизация. Она заключается в удалении из нитратов целлюлозы кислот и побочных продуктов.
Химическая стойкость определяется количеством оксидов азота, выделяемых из 1 г нитратов целлюлозы при нагревании в течение 2 часов при 132±0,4 ºС. Метод основан на том, что процесс разложения нитратов целлюлозы идет при высокой температуре в том же направлении, что и при низкой, различаясь только по скорости (закон Бертло). Однако это наблюдается тогда, когда условия разложения испытываемого продукта при низких температурах практически не отличаются от условий их разложения при высоких температурах.
В пороховой промышленности приняты следующие требования к химической стойкости: для пироксилина №1 – 3 мл NO/г, для пироксилина №2 – 2 мл NO/г. Для пироксилина №2 значение химической стойкости достигается относительно легко, а для пироксилина №1 стабилизация является сложной операцией, требующей значительного времени.
2 Сведения о сырье и материалах, используемых в производстве нитратов целлюлозы
Основным сырьем для получения нитратов целлюлозы является целлюлоза. В производстве применяются также азотная кислота, серная кислота или олеум, используемые для приготовления нитрующих смесей; сода (карбонат натрия) – для стабилизации полученных нитратов целлюлозы; техническая вода, применяемая как транспортное средство при передаче нитратов целлюлозы между фазами, для приготовления соответствующих растворов, отмывки нитратов целлюлозы от примесей и т.д.
2.1 Целлюлоза
Название «целлюлоза» происходит от латинского слова Cellula-клетка, поэтому в старой литературе ее иногда называют клетчаткой, а нитраты целлюлозы – нитроклетчаткой.
Целлюлоза представляет собой природное высокомолекулярное соединение, являющееся основой большинства растений. Ресурсы целлюлозы при рациональном использовании могут возобновляться в практически неограниченных количествах (ежегодно за счет солнечной энергии синтезируется до 2 биллионов тонн целлюлозы).
По своей химической природе целлюлоза относится к сахарам, что доказывается глубоким кислотным гидролизом, при котором получается глюкоза и ее выход составляет 98 – 99 %. Следовательно, структурной единицей целлюлозы является глюкоза и в общей форме ее строение может быть выражено формулой
(С6Н10О5)х,
где х – степень полимеризации.
Глюкоза в некоторых реакциях ведет себя как пяти-
атомный спирт (например, реакция замещения). С другой стороны, глюкоза проявляет свойства восстановителя и может окисляться в кислоту, содержащую то же самое количество углеродных атомов. Это говорит о том, что один из атомов углерода в глюкозе находится в альдегидной группе. Эти реакции дают основание считать глюкозу альдегидоспиртом, причем существовать он может в таутомерных формах: альдегидной и циклической. В целлюлозу глюкоза входит в циклической форме, структурная формула которой имеет вид
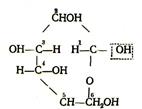 В этой форме глюкоза имеет у первого углеродного атома гидроксильную группу, возникшую из карбоксильной
В этой форме глюкоза имеет у первого углеродного атома гидроксильную группу, возникшую из карбоксильной
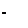 |
группы (альдегидной или кетонной), остальные гидроксильные группы – спиртовые (ацетальные). Эти гидроксильные группы отличаются от первой своей реакционной способностью.
Относительная стойкость целлюлозы к гидролизу кислотами свидетельствует о пиранозной структуре глюкозного звена (внутренний кислородный мостик 1-5), поскольку известно, что пиранозиды более стойки к гидролизу, чем фуранозиды.
Особенность сахаров еще в том, что они могут принадлежать к одной из двух форм: D или L, различающейся расположением водорода у последнего ассиметричного (пятого) атома углерода. Для D характерно его левое расположение (по вращению плоскости поляризации), для L – правое. Глюкоза, входящая в целлюлозу, имеет D-форму.
Исходя из таких представлений, глюкоза как структурная единица является шестичленным циклом, имеющим в положении 1-5 ацетальную связь, которая по сравнению со сложноэфирной связью более устойчива к различным воздействиям.
 |
У большинства полимеров элементарное звено молекулярной цепи является первичной структурной единицей (например, у полистирола – стирол). У целлюлозы элементарное звено и первичная структурная единица не совпадают. Так, у глюкозы все пять гидроксильных групп могут вступать в реакцию, у целлюлозы – только три гидроксильные группы в каждом из глюкозных остатков. Это значит, что при образовании целлюлозы в каждом глюкозном остатке расходуется две гидроксильные группы. Анализ продуктов распада целлюлозы при ее гидролизе в мягких условиях выявил ряд соединений, состоящих из двух, трех и т.д. глюкозных остатков. Наибольший выход имеет целлобиоза – димер глюкозы (до 40 %):
Путем метилирования целлюлозы и последующего кислотного гидролиза, в результате которого происходит расщепление макромолекул до глюкозных остатков, но с сохранением в них метильных групп было выяснено, какие углеродные атомы макромолекул целлюлозы участвуют в образовании связи между глюкозными остатками. На основании указанных реакций была получена 2,3,6-триметилглюкоза, которая имеет связь между глюкозными остатками, аналогичную их связи в целлобиозе: т.е. первый углеродный атом одного глюкозного остатка соединяется с четвертым углеродным атомом другого остатка (связь 1-4).
Гидроксильная группа у первого углеродного атома, как уже отмечалось, отличается повышенной реакционной способностью и легко вступает в реакцию со спиртами, давая глюкозиды [С6Н11О5–ОСН3]. Поэтому связь 1,4 часто называют глюкозидной. По относительному расположению гидроксильных групп у полуацитального (1) и соседнего (2) атомов углерода различают α и β-гликозидные связи. Если обе гидроксильные группы расположены по одну сторону кольца – это α-глюкозид, в противном случае – β-глюкозид.
Таким образом, с точки зрения химического строения целлюлоза – это полисахарид, состоящий из остатков D-глюкопиранозы, соединенных 1,4β-глюкозидной связью [5].
Элементарное звено макромолекулы целлюлозы отвечает химической формуле С6Н7О2(ОН)3. Макромолекулу целлюлозы можно представить в виде длинной цепочки из соединенных друг с другом элементарных звеньев (ангидроглюкозных остатков), причем каждое звено относительно соседнего повернуто на 180 °. Структурная формула макромолекулы целлюлозы имеет вид
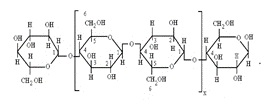
Как видно из структурной схемы, элементарное звено целлюлозы содержит три гидроксильные группы: одна первичная (у шестого атома углерода), две – вторичные (у второго и третьего атомов углерода). Гидроксильная группа у второго углеродного атома обладает повышенными кислотными свойствами и наиболее реакционноспособна в реакциях, протекающих в щелочных средах. Менее реакционноспособна гидроксильная группа у третьего углеводородного атома. В реакциях этерификации наиболее реакционноспособна первичная гидроксильная группа у шестого углеродного атома.
Глюкозидная связь 1,4 обуславливает низкую устойчивость целлюлозы к действию гидролизующих агентов: происходит разрыв связи и деполимеризация макромолекул. Глюкозидная связь есть и в самом кольце (1-5), но она значительно устойчивее, чем связь 1,4. Это можно объяснить ее местоположением, т.к. циклические соединения более устойчивы, чем линейные.
Концевые остатки макромолекул целлюлозы могут содержать гидроксильные группы, альдегидные группы в скрытом состоянии. В присутствии веществ, способных к восстановлению, концевой остаток реагирует как свободная альдегидная группа, которая, окисляясь, переходит в карбоксильную.
 |
Регулярность строения полимерной цепи и строго определенная конфигурация асимметричных атомов углерода позволяют отнести целлюлозу к стереорегулярным полимерам. Элементарные звенья макромолекул могут находиться в конформации кресла (две) и ванны (шесть) в следующем виде:
 |
Ряд свойств целлюлозы и ее производных определяется формой макромолекул. Установлено, что целлюлоза – это один из наиболее жестких гетероцепных полимеров, для которого характерно значительное внутри- и межмолекулярное взаимодействие. Однако, несмотря на интенсивное межмолекулярное взаимодействие, макромолекулы целлюлозы не имеют форму жестких палочек, как считалось раньше. Для них характерно тепловое движение в виде внутреннего вращения отдельных частей молекулы относительно друг друга. В зависимости от условий изменяется степень асимметрии и конфигурация макромолекул. Благодаря своей сгибаемости макромолекулы могут принимать форму клубка, узла, эллипсоида.
Важное значение имеет надмолекулярное строение целлюлозы, т.к. оно практически полностью переносится на нитраты целлюлозы, определяя их морфологическую структуру.
 |
 Простейшим первичным элементом надмолекулярной структуры целлюлозы является пачка (элементарная фибрилла), которая представляет собой пучок из нескольких десятков макромолекул. Макромолекулы упакованы в пачках так, что их концы находятся в разных местах пачки (рис. 3). Поэтому пачки, как правило, намного длиннее макромолекул.
Простейшим первичным элементом надмолекулярной структуры целлюлозы является пачка (элементарная фибрилла), которая представляет собой пучок из нескольких десятков макромолекул. Макромолекулы упакованы в пачках так, что их концы находятся в разных местах пачки (рис. 3). Поэтому пачки, как правило, намного длиннее макромолекул.
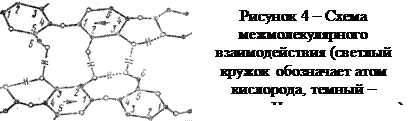
В пачке каждая цепь теряет индивидуальность. Подвижность макромолекулярных цепей в пачке очень мала, поэтому пачки – устойчивые образования. Межмолекулярное взаимодействие в пачке осуществляется тремя типами связей: химической, ван-дер-ваальсовских сил и водородной связи. Химическая связь может быть сложноэфирной в результате взаимодействия карбоксильных групп макромолекулы с гидроксильными группами соседних макромолекул и глюкозидной. Связь за счет ван-дер-ваальсовских сил осуществляется при взаимодействии гидроксильных групп на расстоянии 3 – 5 Ǻ. Если это расстояние меньше, то образуются более прочные водородные связи, играющие основную роль в межмолекулярном взаимодействии. Водородная связь возникает между атомом водорода гидроксильной группы одной макромолекулы и кислородом гидроксильной группы соседней макромолекулы, что можно изобразить схемой, приведенной на рис. 4.
 |
На отдельных участках надмолекулярной структуры (пачки) макромолекулы размещаются настолько упорядочено, что создаются образования, подобные кристаллическим решеткам, – кристаллиты. В то же время на других участках упорядоченность размещения макромолекул нарушена (аморфные участки).
Между кристаллическими и аморфными участками нет четкой границы. Одни и те же макромолекулы могут входить в состав нескольких кристаллических и аморфных участков. Наличие плотных (кристаллических) и рыхлых (аморфных) участков в структурных образованиях приводит к появлению в целлюлозе легко- и труднодоступных зон в волокнах.
Между надмолекулярными образованиями волокна находятся субмикроскопичные щели, образующие капиллярную систему целлюлозных волокон. Само волокно имеет поры, например, внутри волокна, по всей его длине, проходит полость – канал волокна, открытый с одного конца и закрытый с другого. Наличие капиллярно-пористой системы в волокне имеет большое значение. При проведении химических реакций она позволяет реагентам проникать внутрь волокна, где они взаимодействуют с целлюлозой на молекулярном уровне. За счет капиллярно-пористой системы волокна целлюлозы имеют развитую внутреннюю поверхность, которая, например, для хлопковой целлюлозы достигает 18,3 м3/г.
Макромолекулярная структура волокна природной целлюлозы пронизана (инкрустирована) другими веществами: воскоподобными и жировыми соединениями, лигнином, гемицеллюлозами и т.д.[6]. Состав целлюлозы зависит от вида сырья, из которого она получается, и способа его переработки.
Для производства нитратов целлюлозы используется целлюлоза, полученная из хлопка и древесины (преимущественно из хвойных пород).
Хлопковую целлюлозу (ХЦ) получают из линта (коротковолокнистого хлопка длиной 12 – 15 мм), остающегося на семенах хлопчатника после снятия длинного волокна, применяемого для выработки хлопчатобумажной пряжи. Линт, снятый с семян, загрязнен механическими примесями и содержит вещества, препятствующие его химической переработке (азотсодержащие, пектозаны и пектиновые вещества, жиры, воск и минеральные соли). Поэтому линт подвергают очистке и нормируют по вязкости. Процесс получения хлопковой целлюлозы состоит из следующих основных стадий: механическая очистка; варка в растворах щелочи (1,5 – 3 %) под давлением (бучение); промывка водой; отбеливание; промывка и сушка.
Хлопковая целлюлоза является самой чистой. Содержание α-целлюлозы (нерастворимой в 17,5 % едкого натра, растворимая часть называется гемицеллюлозой) составляет 96,0 – 98,2 %; золы (минеральных веществ) – 0,1 – 0,3 %; лигнин, смолы и жиры отсутствуют.
Важной характеристикой целлюлозы является ее вязкость, определяемая как вязкость стандартного медно-аммиачного раствора. В зависимости от вязкости целлюлоза делится на марки, которые обозначаются номером: №15 – 0,01 – 0,02 Па·с (10–20 сП); №25 – 0,021 – 0,030 Па·с (21 –30 сП); №35 – 0,031 – 0,045 Па·с (31 – 45 сП); №70 – 0,046 – 0,085 Па·с (46 – 85 сП) и т.д.
Хлопковая целлюлоза применяется для изготовления высококачественных коллоксилинов, в том числе коллоксилина марки Н, используемого для изготовления баллиститных порохов, отдельных видов пироксилинов (в основном пироксилина №2).
Древесина, используемая для получения целлюлозы, содержит: целлюлозы 40 – 55 %, других гексозанов 5 – 10 %; пентозанов 10 – 20 %; лигнина 20 – 30 %; смолы 2 – 5 %. Чтобы выделить целлюлозу из древесины, ее измельчают и подвергают варке (воздействию водных растворов неорганических веществ при повышенных давлении и температуре в течение нескольких часов). В результате варки происходит растворение всех составных частей, кроме целлюлозы.
В зависимости от способа получения древесная целлюлоза делится на сульфитную и сульфатную. При производстве сульфитной целлюлозы варка производится в кислой среде раствора бисульфита кальция и свободной сернистой кислоты, сульфатной – варка осуществляется в щелочном растворе, содержащем едкий натр, сернистый натрий и ряд других солей. После варки целлюлозу промывают и отбеливают.
Для получения древесной целлюлозы, пригодной к химической переработке, ее подвергают облагораживанию. Сущность облагораживания заключается в обработке отбеленной целлюлозы разбавленными растворами щелочи (6 – 8 % раствор NаОН при температуре 15 – 20 °С или 0,5 – 1 % раствором при температуре 90 – 125 °С). В результате облагораживания в целлюлозе уменьшается содержание примесей и повышается содержание α-целлюлозы.
Древесная целлюлоза в пороховой промышленности используется двух типов: ЦА в виде волокна длиной 3 – 5 мм, РБ – в виде рулонной бумаги, которая затем режется на ромбики с размерами по осям 3 – 5 мм. Причем оба типа могут быть как сульфитной, так и сульфатной целлюлозой.
Сульфитная целлюлоза ЦА и РБ может выпускаться в виде двух марок: К – для изготовления коллоксилинов, П – для изготовления пироксилина (в основном пироксилина марки №1). Содержание в них α-целлюлозы 92 – 94 %, золы не более 0,16 – 0,30 %, смол, жиров и других гидрофобных примесей 0,4 – 0,6 %, вязкость: ЦА – 0,030 – 0,055 Па·с (30 – 55 сП) для марок П и К; РБ – 0,03 – 0,07 Па·с (30 – 70 сП) для марки П и 0,03 – 0,05 Па·с (30 – 50 сП) для марки К. Примеси, содержащиеся в сульфитной целлюлозе, под действием кислорода воздуха и света способны изменяться, что приводит к нестабильности ее характеристик (целлюлоза гидрофобизуется – «стареет»). Так, например, после 5 – 7 мес. хранения целлюлозы марки ЦА ее смачиваемость уменьшается с 125 – 135 до 50 г и ниже.
Сульфатная целлюлоза является более облагороженной, чем сульфитная, по своим характеристикам она приближается к хлопковой целлюлозе. Содержание в ней α-целлюлозы не менее 96 %, золы – не более 0,15 %, смол, жиров – не более 0,07 %. Вязкость для обоих типов целлюлозы ЦА и РБ – не менее 0,02 Па·с (20 сП). Применяется для изготовления коллоксилина марки Н и других видов нитратов целлюлозы.
2.2 Характеристики кислот и других материалов, используемых в производстве нитратов целлюлозы
Другим важным видом сырья в производстве нитратов целлюлозы является азотная кислота, используемая в нитрующей смеси. Концентрированная азотная кислота представляет собой бесцветную жидкость с едким удушливым запахом. Молекулярная масса азотной кислоты 63, плотность 1521 кг/м3 (при t=15 оС), вязкость 0,893 мПа·с (при t=20 оС), температура кипения 86 оС, удельная теплоемкость 1,759 кДж/кг (при t=20 оС), удельная теплота испарения 482 кДж/кг. С водой смешивается в любых соотношениях.
Азотная кислота не горюча и не взрывоопасна. Однако при попадании концентрированной азотной кислоты на солому, бумагу, древесину, нефтепродукты и другие органические вещества возможно их воспламенение, а при взаимодействии с органическими растворителями (спиртом, скипидаром и т.д.) возможен взрыв.
При обращении с азотной кислотой в производстве необходимо учитывать зависимость ее температуры замерзания от концентрации (табл. 3).
Таблица 3 – Температура замерзания растворов НNO3
| Массовая доля, % | 34,1 | 53,5 | 58,5 | 69,7 | 70,5 | 88,8 | 94,8 | |||
| Температура замерзания,оС | - 40 | -30 | -20 | -18,5 | -20 | - 40 | - 42 | -60 | -51 | - 41 |
В применяемой в производстве нитратов целлюлозы азотной кислоте массовая доля моногидрата (НNO3) должна быть не менее 97,5 %. Массовая доля примесей в виде серной кислоты не более 0,06 %, азотистой кислоты не более 0,3 %, других примесей не более 0,02 %. Может использоваться также кислотный меланж, состоящий из азотной и серной кислоты (массовая доля 7,5 %). Массовая доля примесей в виде оксидов азота (N2O4) не более 0,3 % и других примесей не более 0,04 %.
Нитрующая кислотная смесь, используемая при нитрации целлюлозы, включает серную кислоту с массовой долей моногидрата (Н2SО4) не менее 92,5 % или олеум с массовой долей свободного серного ангидрида не менее 19 % (105%). Серная кислота представляет собой бесцветную маслянистую жидкость. Молекулярная масса серной кислоты 98,078, плотность 1830,5 кг/м3 (при t=200 С). Температура кристаллизации серной кислоты в зависимости от ее концентрации приведена в таблице 4.
Таблица 4 – Температура кристаллизации Н2SО4
| Массовая доля, % | 37,6 | 68,3 | 73,2 | 84,5 | 93,3 | ||
| Температура кристаллизации, 0С | -74,5 | -24,4 | - 45,7 | -39,6 | - 41,0 | -8,45 | -37,8 |
Серная кислота является одной из активных неорганических кислот, реагирует почти со всеми металлами и их оксидами, вступая в реакцию обменного разложения. Особенно агрессивны водные растворы серной кислоты при нагревании. Однако холодная концентрированная кислота не действует на металлы, что позволяет ее хранить и транспортировать в емкостях из углеродистой стали.
В производстве нитратов целлюлозы применяются щелочные растворы, которые приготавливаются с использованием соды (Nа2СO3) с массовой долей карбоната натрия не менее 97 % для стабилизации нитратов целлюлозы, а также окиси кальция СаО (негашеная известь) для нейтрализации сточных вод.
Наконец, в производстве нитратов целлюлозы в большом количестве используется техническая вода, которая играет значительную роль в технологическом процессе. Чистота воды, применяемой в производстве, является одним из факторов, определяющих качество конечного продукта. Особенно высокие требования предъявляются к воде при изготовлении высококачественных коллоксилинов (целлулоидных, лаковых и др.).
Используемая при получении нитратов целлюлоза вода должна удовлетворять таким показателям: цветности,мутности, жесткости, содержания хлоридов, железа, марганца, а также должна иметь соответствующий водородный показатель (рН).
Цветность воды обусловлена главным образом наличием в воде гумусовых веществ коллоидных соединений железа, придающих воде оттенки от желтых до зеленых, а также примесей, попадающих с промышленными стоками. Цветность воды определяется по специальной (платиново-кобальтовой) шкале в градусах цветности. Для получения качественных коллоксилинов показатель цветности воды должен быть не более 5. Для пироксилинов, к которым предъявляются менее жесткие требования, цветность воды может быть не более 20.
Мутность воды характеризуется количеством примесей и взвешенных веществ, не способных к осаждению в обычных условиях. К ним относятся в основном органические соединения, а также мельчайшие хлопья коагулянта. Мутность воды измеряется по стандартной шкале: для высококачественных коллоксилинов она не более 0,2 мг/л, для пироксилина не более 1,5 мг/л. В производственных условиях часто пользуются показателем прозрачности, измеряемым по заводским методикам.
Жесткость воды характеризуется содержанием в воде солей кальция и магния. Карбонатная, или временная, жесткость вызывается содержанием в воде бикарбонатов (гидрокарбонатов) Са и Мg. Эта жесткость почти полностью удаляется при кипячении воды, когда бикарбонаты подвергаются распаду с образованием карбонатов и углекислоты. Некарбонатная, или постоянная, жесткость вызывается содержанием остальных солей. Сумма временной и постоянной жесткостей составляют общую жесткость. Она характеризуется содержанием в 1 л воды миллиграмм-эквивалентов двухвалентных металлов.
На фазе стабилизации нитратов целлюлозы, где процесс ведется при температуре кипения, используется умягченная вода, так как образующиеся карбонаты оседают на волокнах нитратов целлюлозы, увеличивая их зольность. С другой стороны, бикарбонатные соли кальция и магния способствуют разрушению малостойких примесей, т.е. повышению стойкости нитратов целлюлозы. Поэтому при изготовлении пироксилинов применяют воду с жесткостью 7 мл·экв/л, что соответствует требованиям к питьевой воде. Но нитраты целлюлозы темнеют в процессе стабилизации тем больше, чем больше жесткость воды. При этом с повышением температуры потемнение идет более интенсивно. Это не оказывает существенного влияния на пироксилины и коллоксилин марки Н. При изготовлении же целлулоидных, лаковых и др. коллоксилинов от жесткости воды зависит цветность коллоксилина. Поэтому для коллоксилинов с повышенными требованиями по качеству применяемая вода должна иметь общую жесткость не более 3 мл·экв/л.
Соли железа и марганца, содержащиеся в воде, отрицательно влияют на качество нитратов целлюлозы, в первую очередь цветность. Это связано с адсорбцией ионов железа и марганца нитратами целлюлозы. Поэтому для изготовления коллоксилинов содержание в воде железа должно быть не более 0,05 мг/л; для пироксилинов допускается до 0,3 мг/л. Для изготовления высококачественных коллоксилинов присутствие марганца в технологической воде нежелательно, т.к. он может выпадать на волокна нитратов в виде черной окиси.
Хлориды мало влияют на качество нитратов, но наличие в воде свыше 50 мг/л хлоридов (в пересчете на хлор-ион) в кислой среде оказывает коррозионное действие на оборудование. Поэтому содержание хлоридов в воде желательно иметь не более 30 мг/л.
Водородный показатель (рН) характеризует степень загрязнения воды кислотами и щелочами. При изготовлении пироксилинов величина рН воды должна находиться в пределах 6,6 – 8,5; при изготовлении коллоксилинов величина рН должна быть не менее 7,2.
3 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА НИТРАТОВ ЦЕЛЛЮЛОЗЫ
Технологический процесс производства нитратов целлюлозы включает ряд химических и физико-химических превращений, происходящих как во время основной фазы нитрации, так и на последующих операциях, цель которых – придать нитратам целлюлозы нужные свойства.
Дата добавления: 2016-06-15; просмотров: 4792;











