Технологические показатели
Сухой остаток —суммарное количество растворенных в воде неле-тучих молекулярно-дисперсных и коллоидных веществ, мг/дм3.
Его определяют упариванием 1 дм3 профильтрованной воды, подсу-шивая остаток при 105 оС до постоянного веса и взвешивая его.
Если сухой остаток прокалить при 800 оС, вес его снижается, получа-ется прокаленный остаток. Уменьшение веса происходит вследствие сго-рания органических веществ, разложения карбонатов и удаления остатков воды.
Общая жесткость воды Жо —суммарная концентрация ионов Са2 и Mg 2 , выраженная в эквивалентных единицах мг-экв/дм3.
Для пересчета концентрации кальция и магния, выраженных в мг/дм3, в мг-экв/дм3 их делят на эквивалентные веса этих катионов:

Общую жесткость Жо подразделяют на карбонатную и некарбонатную.
Карбонатная жесткость Жк в основном обусловлена присутствием в воде бикарбонатов кальция и магния — Са(НСО3 )2 и Mg(НСО3 )2 . Если кон-
центрация ионов HCO3 меньше общей жесткости HCO3 (Ca2 Mg 2 ) , то карбонатная жесткость определяется концентрацией иона HCO3 .
Если концентрация ионов HCO3 больше общей жесткости, то карбо
натную жесткость условно принимают равной общей жесткости, а некар-бонатную — равной нулю.
Некарбонатная жесткость Жнк обуславливается наличием в воде хло-ридов, сульфатов и других некарбонатных солей кальция и магния.
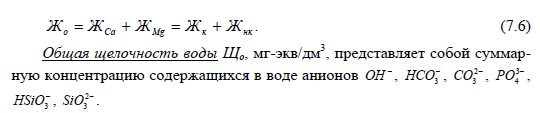
Значение общей щелочности определяется количеством кислоты, из-расходованным на титрование пробы воды первоначально в присутствии индикатора фенолфталеина, а затем метилоранжа.
В зависимости от щелочных анионов различают: гидратную щелочность Щг (содержание ОН ); карбонатную щелочность Щк (содержание CO32 );
бикарбонатную щелочность Щб (содержание HCO3 );
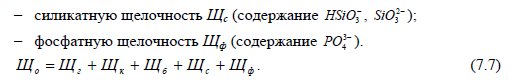
В большинстве природных вод концентрация бикарбонатных ионов преобладает над концентрацией других анионов слабых кислот, поэтому общая щелочность обычно совпадает с концентрацией бикарбонатов.
Карбонатный индекс является обобщенным показателем,характери-зующим накипеобразующую способность воды,

Окисляемость воды —это показатель,имеющий целое значение ипредставляющий собой расход какого-либо сильного окислителя, необхо-димого для окисления в определенных условиях органических примесей, содержащихся в 1 дм3 воды, которые непосредственно не определяются.
В качестве окислителя применяют перманганат калия, бихромат ка-лия. Результаты определения окисляемости выражают в мг/л в пересчете на
О2.
Подземные воды имеют небольшую окисляемость от 0,5 до 2 мгО2/дм3, в водах поверхностных источников окисляемость достигает 10-12 мгО2/дм3.
Индекс стабильности —индекс насыщения воды карбонатом каль-
ция.
Используется для характеристики накипеобразующих и коррозионных свойств как природной, так и теплофикационной воды.
Для данной температуры воды индекс стабильности рассчитывается по формуле

где рН — измеренное значение рН воды с поправкой на температуру ее на-грева; рНS — рН равновесного насыщения воды карбонатом кальция при данной температуре (определяется по номограммам).
Если J<0, т. е. рН < рНS, вода содержит агрессивную углекислоту (аг-рессивная вода).
Если рН = рНS, вода стабильная, т. е. не вызывает коррозии и не обра-зует накипи.
Если J>0, т. е. рН < рНS, вода способна к отложению карбоната каль-ция (нестабильная вода).
Концентрация растворенных в воде газов таких,как кислород и диок-
сид углерода (свободная углекислота), оказывает значительное влияние на интенсивность внутренней коррозии металла. С увеличением концентра-ции коррозия усиливается, а с уменьшением — скорость коррозии замед-ляется.
Концентрацию СО2 определяют титрованием пробы воды NaOH в присутствии фенолфталеина.
Концентрацию О2 определяют сравнением пробы воды с добавлением метиленового голубого с эталоном или с помощью специальных приборов
— кислородомеров.
Концентрация растворенных в воде газов зависит от температуры во-ды, парциального давления газа над водой, рН воды. При рН=8,33 свобод-ная углекислота в воде отсутствует.
Дата добавления: 2016-06-15; просмотров: 3150;











