Классификация и номенклатура аминокислот.
Общая характеристика (строение, классификация, номенклатура, изомерия).
Основной структурной единицей белков являются a-аминокислоты. В природе встречается примерно 300 аминокислот. В составе белков найдено 20 различных a-аминокислот (одна из них – пролин, является не амино-, а иминокислотой). Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
a-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у a-углеродного атома замещен на аминогруппу (–NН2), например:
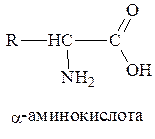
Различаются аминокислоты по строению и свойствам радикала R. Радикал может представлять остатки жирных кислот, ароматические кольца, гетероциклы. Благодаря этому каждая аминокислота наделена специфическими свойствами, определяющими химические, физические свойства и физиологические функции белков в организме.
Именно благодаря радикалам аминокислот, белки обладают рядом уникальных функций, не свойственных другим биополимером, и обладают химической индивидуальностью.
Значительно реже в живых организмах встречаются аминокислоты с b- или g-положением аминогруппы, например:
Классификация и номенклатура аминокислот.
Существует несколько видов классификаций аминокислот входящих в состав белка.
А) В основу одной из классификаций положено химическое строение радикалов аминокислот. Различают аминокислоты:
1. Алифатические – глицин, аланин, валин, лейцин, изолейцин:
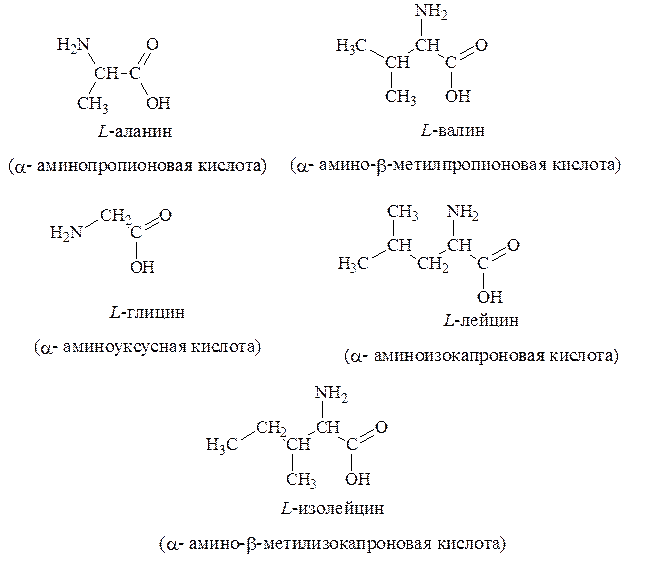
2. Гидроксилсодержащие – серин, треонин:
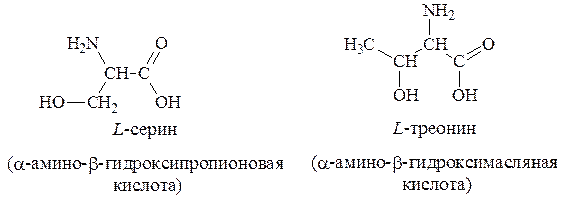
3. Серосодержащие – цистеин, метионин:
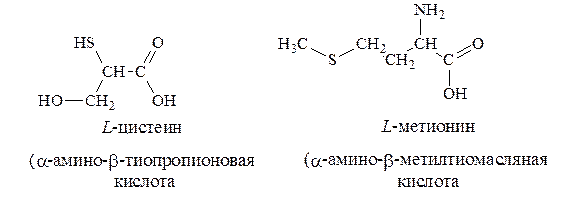
4. Ароматические – фенилаланин, тирозин, триптофан:
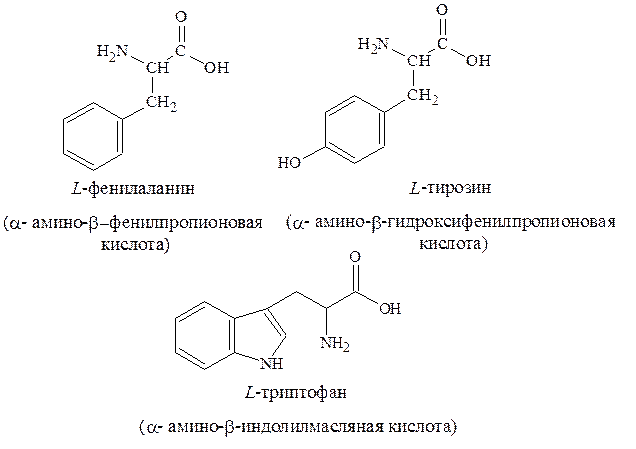 5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
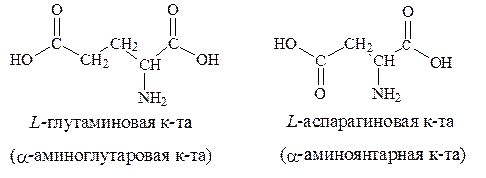
6. и амиды-аспарагиновой и глутаминовой кислот – аспарагин, глутамин.
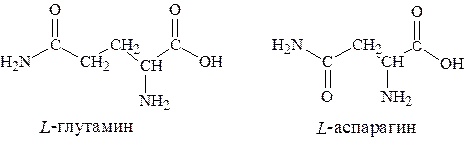
7. Основные – аргинин, гистидин, лизин.
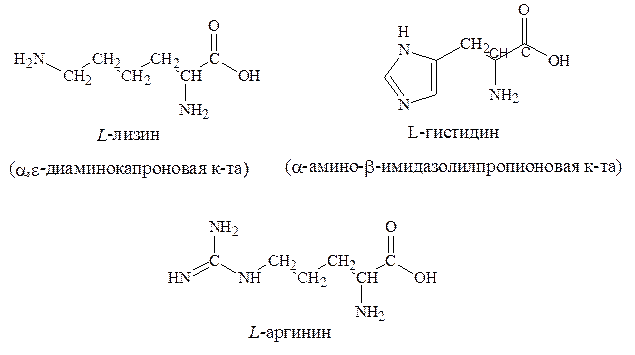 8. Иминокислота – пролин
8. Иминокислота – пролин
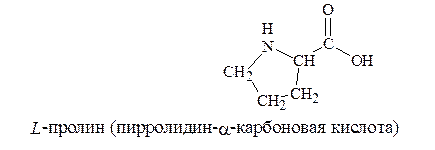 |
Б) Второй вид классификации основан на полярности R-групп аминокислот.
Различают полярные и неполярные аминокислоты. У неполярных в радикале есть неполярные связи С–С, С–Н, таких аминокислот восемь: аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин.
Все остальные аминокислоты относятся к полярным (в R-группе есть полярные связи С–О, С–N, –ОН, S–H). Чем больше в белке аминокислот с полярными группами, тем выше его реакционная способность. От реакционной способности во многом зависят функции белка. Особенно большим числом полярных групп, характеризуются ферменты. И наоборот, их очень мало в таком белке как кератин (волосы, ногти).
В) Аминокислоты классифицируют и на основе ионных свойств R-групп(таблица 1).
Кислые (при рН=7 R-группа может нести отрицательный заряд) это аспарагиновая, глутаминовая кислоты, цистеин и тирозин.
Основные (при рН=7 R-группа может нести положительный заряд) – это аргинин, лизин, гистидин.
Все остальные аминокислоты относятся к нейтральным (группа R незаряжена).
Таблица 1 – Классификация аминокислот на основе полярности
R-групп.
| Аминокислоты | Принятые однобуквенные обозначения и символы | Изоэлектрическая точка, рI | Среднее содержание в белках,% | ||||
| Англ. | символ | Русск. | |||||
1. Неполярные R-группы
Глицин
Аланин
Валин
Лейцин
Изолейцин
Пролин
Фенилаланин
Триптофан
2. Полярные, незаряженные R-группы
Серин
Треонин
Цистеин
Метионин
Аспарагин
Глутамин
R-группы Тирозин Аспарагиновая к-та Глутаминовая к-та Цистеин 4. Положительно заряженные Лизин Аргинин Гистидин | GLy ALa VaL Leu Lie Pro Phe Trp Ser Thr Cys Met Asn GLn Tyr Asp GLy Lys Arg His | G A V L I P F W S T C M N Q Y D E K R N | Гли Ала Вал Лей Иле Про Фен Трп Сер Тре Цис Мет Асн Глн Тир Асп Глу Лиз Арг Гис | 5,97 6,02 5,97 5,97 5,97 6,10 5,98 5,88 5,68 6,53 5,02 5,75 5,41 5,65 5,65 2,97 3,22 9,74 10,76 7,59 | 7,5 9,0 6,9 7,5 4,6 4,6 3,5 1,1 7,1 6,0 2,8 1,7 4,4 3,9 3,5 5,5 6,2 7,0 4,7 2,1 |
Г) По числу аминных и карбоксильных групп аминокислоты делятся:
– на моноаминамонокарбоновые, содержащие по одной карбоксильной и аминной группе;
– моноаминодикарбоновые (две карбоксильные и одна аминная группа);
– диаминомонокарбоновые (две аминные и одна карбоксильная группа).
Д) По способности синтезироваться в организме человека и животных все аминокислоты делятся:
– на заменимые,
– незаменимые,
– частично незаменимые.
Незаменимые аминокислоты не могут синтезироваться в организме человека и животных они обязательно должны поступать вместе с пищей. Абсолютно незаменимых аминокислот восемь: валин, лейцин,изолейцин,треонин,триптофан, метионин,лизин, фенилаланин.
Частично незаменимые - синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются арганин, гистидин, тирозин.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве из других соединений. Растения могут синтезировать все аминокислоты.
Изомерия
В молекулах всех природных аминокислот (за исключением глицина) у a-углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и получил название хирального атома. Вследствие этого растворы аминокислот обладают оптической активностью – вращают плоскость плоскополяризованного света. Число возможных стереоизомеров ровно 2n, где n – число асимметрических атомов углерода. У глицина n = 0, у треонина n = 2. Все остальные 17 белковых аминокислот содержат по одному асимметрическому атому углерода, они могут существовать в виде двух оптических изомеров.
В качестве стандарта при определении L и D-конфигураций аминокислот используется конфигурация стереоизомеров глицеринового альдегида.
Расположение в проекционной формуле Фишера NH2-группы слева соответствуют L-конфигурации, а справа – D-конфигурации.
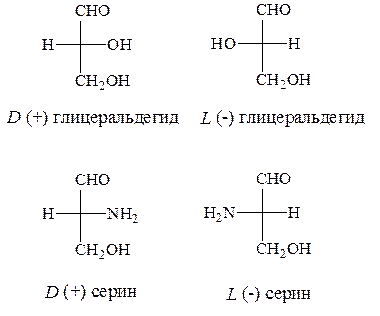
Следует отметить, что буквы L и D означают принадлежность того или иного вещества по своей стереохимической конфигурации к L или D ряду, независимо от направленности вращения.
Кроме 20 стандартных аминокислот встречающихся почти во всех белках, существуют еще нестандартные аминокислоты, являющиеся компонентами лишь некоторых типов белков – эти аминокислоты называют еще модифицированными (гидроксипролин и гидроксилизин).
Методы получения
– Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды.
При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты.
Синтетические способы получения аминокислот:
– Действие аммиака на галоидзамещённые кислоты
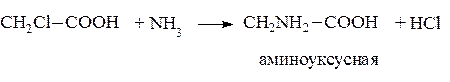
– α-Аминокислоты получают действием аммиака на оксинит-рилы
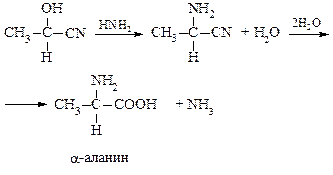
Дата добавления: 2016-06-15; просмотров: 11458;











