Рефрактометр Аббе, основанный на использовании явления полного внутреннего отражения, используют для определения n жидкостей.
А' II С'
 А
А 

В'
С I В
Рис.9. Расположение призм в рефрактометре
Несколько капель исследуемой жидкости помещают между двумя гипотенузными гранями призм I и II. Призма I с отполированной гранью АВ является измерительной, а призма II с матовой гранью А'В' – осветительной. От источника света лучи падают на грань В'С', преломляются и падают на матовую поверхность А'В', вследствие рассеяния света матовой поверхностью в исследуемую жидкость входят лучи различных направлений. Далее лучи, пройдя жидкость, падают на поверхность АВ призмы I (рис.9). Так как nж<nс, то лучи всех направлений, преломившись на границе жидкость – стекло войдут в призму I. Максимальное значение угла преломления b соответствует углу падения a=90о. По закону преломления Снелля nc·sinb=nж·sina. Так как зазор между призмами I и II очень мал, то можно считать, что лучи с наибольшим углом падения является скользящими, то есть a=90%, тогда nж=nс·sinb.
В поле зрения трубы справа по ходу луча окажется темнота, слева – свет. Положение границы света и тени определяется соотношением показателей преломления жидкости и стекла. Наблюдая в зрительную трубу, вращением маховика совмещают неокрашенную границу света и тени с перекрестием и по шкале прибора (слева) делают отсчет величины nж.
Основные понятия оптической спектроскопии
Спектроскопия ‑ это раздел науки, занимающийся изучением качественного и количественного состава электромагнитного излучения (поглощенного, рассеянного, испускаемого или отраженного веществом). Электромагнитное излучение, разложенное по длинам волн или по энергии, образует спектр.
Классификацию спектроскопии, как и спектров, проводят по различным признакам. По диапазонам длин электромагнитных волн в спектроскопии выделяют радиоспектроскопию, охватывающую всю область радиоволн (λ=10-4÷10-2 м); оптическую спектроскопию, изучающую оптические спектры (λ=10-8÷10-4 м) и включающую в себя инфракрасную и ультрафиолетовую спектроскопию; рентгеновскую спектроскопию (λ=10-8÷10-10 м) и гаммаспектроскопию (λ=10-10÷10-11 м).
По типам исследуемых систем спектроскопию разделяют на атомную, изучающую атомные спектры; молекулярную, изучающую молекулярные спектры; спектроскопию веществ в конденсированном состоянии.
Свойства электромагнитного излучения отражают явления взаимодействия света с веществом.
Электромагнитное излучение обладает одновременно как волновыми, так и корпускулярными свойствами.
Электромагнитные волны представляют собой быстропеременные электрические и магнитные поля, которые изменяются по тому или иному закону в зависимости от свойств источника, испускающие эти поля, и среды, в которой они распространяются.
Распространение электромагнитных волн подчиняется уравнению Максвелла. Теория Максвелла показывает, что направления электрического 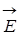 и магнитного
и магнитного 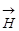 векторов в электромагнитной волне взаимно перпендикулярны.
векторов в электромагнитной волне взаимно перпендикулярны. 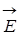 и
и 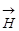 изменяются так, что они, одновременно проходя через максимум и минимум, распространяются волнообразно с общей скоростью
изменяются так, что они, одновременно проходя через максимум и минимум, распространяются волнообразно с общей скоростью
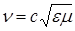 ,
,
где ε и μ – соответственно относительная диэлектрическая и магнитная проницаемость среды;
с – скорость света в вакууме, равная 3·108 м/с.
Под светом обычно понимается электромагнитное излучение в интервале длин волн 10-11÷10-4 м. Электромагнитное излучение в области 4·10-7÷7,6·10-7 м воспринимается непосредственно глазом и называется видимым светом.
Согласно квантовой корпускулярной теории поглощение, излучение, а также распространение света происходит дискретно – квантами:
 Е = hν,
Е = hν,
где Е – энергия кванта;
ν – частота колебаний электромагнитной волны;
h – постоянная Планка, равная 6,626·10-34 Дж·с.
Излучение и поглощение атомами электромагнитных волн связано с переходами электронов с одних энергетических уровней на другие, причем энергия излучения или поглощения при каждом таком переходе определяется как
hνmn=Em-En,
где νmn ‑ частота электромагнитного излучения, поглощенного (излученного) при переходе электронов с энергетического уровня Em на энергетический уровень En.
Если m > n ‑ происходит поглощение излучения извне.
Совокупность переходов с нижних уровней на верхние дает спектр поглощения, с верхних уровней на нижние ‑ спектр испускания.
Таким образом, в атомах существенную роль играет только движение электронов.
В молекулах наряду с движениями электронов существенную роль играют колебательное и вращательное движения молекулы.
Полная энергия молекулы Е может быть представлена как сумма энергий электронного Еэл., колебательного Екол. и вращательного Евр. движения
Е=Еэл.+Екол.+Евр.
Частота излучения молекулами света ν будет определяться формулой:
 ν = (Еm-Еn) /h = (Еm(эл.)-Еn(эл.))/ h +( Еm(кол.) - Еn(кол.))/h+( Еm(вр.)-Еn(вр.))/h
ν = (Еm-Еn) /h = (Еm(эл.)-Еn(эл.))/ h +( Еm(кол.) - Еn(кол.))/h+( Еm(вр.)-Еn(вр.))/h
Различие в энергии между наиболее низким и первым возбужденным состояниями составляет 2-10 эВ (1 эВ равен 1,602.10-19 Дж) для энергий электронного движения; 0,2-2 эВ ‑ для колебательных энергий и 10-5-10-3 эВ – для вращательных энергий.
Спектральные линии испускания и поглощения, соответствующие электронным переходам, обычно расположены в самой близкой инфракрасной, видимой и ультрафиолетовых областях спектра (λ=0,1÷1 мкм). Линии соответствующие колебательным переходам, лежат в близкой инфракрасной области спектра (λ=1÷50 мкм), а линии чисто вращательного спектра расположены в далекой инфракрасной области спектра (λ=50÷2000 мкм).
Основные компоненты пищевых систем представляют собой сложные органические соединения, поглощательные, излучательные, преломляющие свойства которых определяются в основном специфическими особенностями их состава, структуры, а также характером химической связи.
Присутствие в них таких функциональных групп, как –N=N‑, ‑HC=CH‑, =C=O, ‑C=C‑ и др. вызывает поглощение в ближней ультрафиолетовой и видимой областях. Такие ненасыщенные группы называются хромофорными.
 Некоторые группы усиливают поглощение, хотя сами не поглощают в данной области спектра (например, NH2‑OH), они называются ауксохромными.
Некоторые группы усиливают поглощение, хотя сами не поглощают в данной области спектра (например, NH2‑OH), они называются ауксохромными.
 Ауксохромы могут сдвигать спектр поглощения (и связанный с ним спектр излучения) или в длинноволновую область (батохромный сдвиг), или в коротковолновую (гипсохромный сдвиг), а также вызывать либо увеличение интенсивности (гиперхромный эффект), либо ее уменьшение (гипохромный эффект).
Ауксохромы могут сдвигать спектр поглощения (и связанный с ним спектр излучения) или в длинноволновую область (батохромный сдвиг), или в коротковолновую (гипсохромный сдвиг), а также вызывать либо увеличение интенсивности (гиперхромный эффект), либо ее уменьшение (гипохромный эффект).
 Наличие в молекулах анализируемых веществ сопряженных (конъюгированных) связей оказывает значительное влияние на характер спектров поглощения. Происходит смещение полос поглощения в длинноволновую область спектра с одновременным увеличением интенсивности.
Наличие в молекулах анализируемых веществ сопряженных (конъюгированных) связей оказывает значительное влияние на характер спектров поглощения. Происходит смещение полос поглощения в длинноволновую область спектра с одновременным увеличением интенсивности.
 Например, при окислении полиненасыщенных жирных кислот образуются конъюгированные изомеры, поглощающие в области длин волн 230-260 нм. β-каротин, который имеет восемь двойных сопряженных связей, обладает сильным поглощением в видимой области при 420-480 нм, в то время как витамин А, который образуется при расщеплении β-каротина по центральной двойной связи, поглощает только в ближней ультрафиолетовой области.
Например, при окислении полиненасыщенных жирных кислот образуются конъюгированные изомеры, поглощающие в области длин волн 230-260 нм. β-каротин, который имеет восемь двойных сопряженных связей, обладает сильным поглощением в видимой области при 420-480 нм, в то время как витамин А, который образуется при расщеплении β-каротина по центральной двойной связи, поглощает только в ближней ультрафиолетовой области.
Спектрофотометрия
 При взаимодействии электромагнитного излучения с веществом всегда имеет место соотношение, выражающее закон сохранения энергии, падающей на вещество в единицу времени, т.е. падающий поток излучения Φо равен сумме поглощенного Φа, отраженного Φr и пропущенного веществом потока Φт:
При взаимодействии электромагнитного излучения с веществом всегда имеет место соотношение, выражающее закон сохранения энергии, падающей на вещество в единицу времени, т.е. падающий поток излучения Φо равен сумме поглощенного Φа, отраженного Φr и пропущенного веществом потока Φт:
Φо = Φа + Φr + Φт или A+ R + T =1
R = Φа/Φо – коэффициент поглощения;
R = Φr /Φо ‑ коэффициент отражения;
Т = Φт/Φо – коэффициент пропускания.
 При прохождении через однородную среду монохроматографического луча света ослабление интенсивности светового потока описывается законом Бугера:
При прохождении через однородную среду монохроматографического луча света ослабление интенсивности светового потока описывается законом Бугера:
Φλ = Φоλ exp(-xl) или Tλ = exp(-xλl),
где Φоλ и Φλ – соответственно интенсивности падающего и прошедшего через анализируемый слой (l) вещества света при монохроматической длине света (λ).
 хλ ‑ показатель поглощения.
хλ ‑ показатель поглощения.
 Объединенный закон Бугера-Ламберта-Бера устанавливает следующую зависимость:
Объединенный закон Бугера-Ламберта-Бера устанавливает следующую зависимость:
Φλ = Φоλ exp(-xоλcl),
где с ‑ концентрация вещества, моль/л;
l ‑ толщина исследуемого слоя вещества, см.
Логарифм величины обратной пропусканию носит название погашения (экстинции) или оптической плотности D:
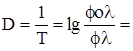 xcl.
xcl.
Графическая зависимость «D-с» представляет собой прямую линию, проходящую через начало координат. Методом экстраполяции определяют концентрацию анализируемого вещества на градуировочной прямой (D-С).
Применяют также метод добавок.
При соблюдении основного закона светопоглощения при постоянной толщине слоя отношение оптических плотностей исследуемого раствора и исследуемого раствора с добавкой будет равно отношению их концентраций:
Dх/Dх + а = Сх/(Сх+Са), откуда:
Сх = СаDх/(Dх + а-Dх),
где Dх - оптическая плотность исследуемого раствора;
Dх+а – оптическая плотность исследуемого раствора с добавкой;
Сх – неизвестная концентрация определяемого вещества в исследуемом растворе;
Са ‑ концентрация добавки (Сдоб.) она связана соотношением:
Са = СдобVдоб/Vx +a
Добавки следует брать в таких количествах, чтобы не происходило «потери точности при вычитании»; минимальная разность Dх+а-Dх должна быть не менее 0,1.
При большом солевом фоне, особенно когда примеси взаимодействуют с реагентом, метод добавок может привести к получению завышенных результатов, из-за отклонений от закона Бугера-Ламберта-Бера.
Приборы, используемые для измерения светопоглощения фотоэлектроколориметры, спектрофотометры, принцип работы которых заключается в преобразовании световой энергии в электрическую с помощью фотоэлементов (явление фотоэффекта).
Спектрофотометры с автоматической запись спектров поглощения позволяют непосредственно получить зависимость D от λ.
По спектру определяют длину волны максимального поглощения.
Большое число методик фотометрического анализа посвящено также определению микроэлементов (Fe, Ni, Co, Zn, Pb, Mo и т.д.), основанных на предварительном получении окрашенных комплексных соединений с такими реагентами, как дитизон, роданид аммония, диметилглиоксим, ферроцианид калия и др.
Нижний предел обнаружения составляет n·10-5 моль/л.
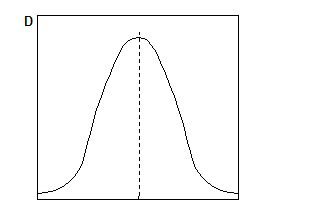
lмакс λ, нм
Рис.10. Спектр поглощения
Атомно-абсорбционный анализ
Атомно-абсорбционная спектроскопия – это аналитический метод определения, основанный на поглощении электромагнитного излучения свободными (невозбужденными) атомами.
Атомно-абсорбционный анализ основан на явлении абсорбции резонансного излучения, представляющего собой характеристическое излучение, соответствующее переходу электрона из основного состояния на ближайший более высокий энергетический уровень.
В ходе анализа часть анализируемого образца переводят в атомный пар (аэрозоль) и измеряют поглощение излучения резонансного (характеристического) для данного определяемого элемента. Атомный пар получают распылением раствора анализируемого вещества в пламени. Атомы элемента, находящиеся в плазме в невозбужденном (свободном) состоянии, поглощают характеристическое резонансное излучение определенной для каждого элемента длины волны. В результате этого электрон атома переходит на более высокий энергетический уровень. При этом одновременно пропускаемое через плазму излучение ослабляется.
Основным преимуществом метода является использование резонансного излучения, вследствие чего процесс является высокоселективным.
Поглощение резонансного света атомами описывается законом убывания интенсивности проходящего через плазму монохроматического излучения (Iυ), которое зависит от толщины слоя плазмы (l) и концентрации (с) поглощающих световую энергию атомов:
Iυ = I0 exp(-кυlС),
где кυ – коэффециент поглощения.
I0 – интенсивность падающего на плазму монохроматического излучения.
При преобразовании выражения получаем:
A = lg (I0/Iυ) = кυlС,
где А – абсорбционность поглощающего слоя плазмы.
Эта зависимость аналогична закону Бугера-Ламберта-Бера и графически выражается прямой линией. Но коэффициенты атомного поглощения характеризуются значениями порядка n·108, т.е. на три порядка больше молярных коэффициентов светопоглощения для цветных реакций в водных растворах (n·105).
Наряду с высокой селективностью, метод практически свободен от эффектов спектрального наложения, характерных для явлений эмиссии, мало чувствителен к изменениям температуры пламени.
Благодаря высокой чувствительности (10-5%) метод позволяет работать с малыми количествами веществ, обладает большой экспрессностью.
Установки для атомно-абсорбционной спектроскопии всегда содержат разрядную трубку (т.е. лампу с полым катодом, изготовленную из определяемого элемента), горелку атомизатор или графитовую кювету, монохроматор, фотоумножитель и выходной измерительный прибор.
Для диспергирования излучений в монохроматорах служат призмы или дифракционные решетки.
Используют главным образом, ультрафиолетовую и видимую область спектра.
Для атомизации различных элементов используют пламя: воздух-пропан, воздух-водород, воздух-ацетилен, оксид азота (I) – ацетилен и др.
При выделении определяемого элемента из исследуемого образца с помощью экстракции или хроматографии можно повысить на порядок чувствительность метода (экстракционно-атомно-абсорбционный вариант).
Выпускают атомно-абсорбционные спектрометры различных типов, с чувствительностью определения элементов 0,01-0,5 мкг/мл.
Приборы комплектуются набором катодных ламп для различных металлов. В основе метода лежит способ построения градуировочного графика. Вначале измеряют абсорбцию эталонных растворов, строят градуировочный график в координатах “А-С” и затем, измерив величину абсорбции анализируемой пробы, находят концентрацию определяемого элемента.
Атомно-абсорбционный метод – это универсальный метод определения микроколичеств металлов (и некоторых неметаллов). Описаны методы атомно-абсорбционной спектрометрии около 80 элементов в образцах проб различных отраслей промышленности. Он используется в металлургической, горной, химической, пищевой промышленности, в сельском хозяйстве, экологических исследованиях, биохимии и медицине, анализе природных, а также промышленных сточных вод на содержание следов металлов.
Дата добавления: 2022-02-05; просмотров: 497;











