Тема 7 Растворы электролитов. Электролитическая диссоциация. Ионное произведение воды. Гидролиз
Электролитическая диссоциация – распад молекул на ионы в растворе или расплаве.
Электролитическая диссоциация соединений разных классов:
кислот HNO3 = H+ + NO3–
HCl = H+ + Cl–
СН3СООН = H+ + CН3СОО–
H2SO4 (разб.) = 2H+ + SO42−
многоосновных кислот ступенчато, в основном по первой ступени:
H3РО4 = H+ + H2РО4– (первая ступень)
H2РО4– = H+ + HРО42– (вторая ступень)
HРО42– = H+ + РО43– (третья ступень)
H2SO4 (конц.) H+ + =HSO4−
HSO4− = H+ + SO42−
оснований NaOH = Na+ + OH–
многокислотных оснований ступенчато, в основном по первой ступени
Ва(OH)2=ВаOH++OH–(первая ступень)
ВаOH+ ⇄ Ва2+ + OH– (вторая ступень)
амфотерных оснований как оснований (в кислой среде):
Al(OH)3↓ = Al(OH)2+ + +OH−
Al(OH)2+ = Al(OH)2+ + + OH−
Al(OH)2+ = Al3+ + OH−
как кислот (в щелочной среде):
H3AlO3↓ = H2AlO3−+ H+
H2AlO3− = HAlO32− + H+
HAlO32− = AlO33− + H+
В щелочной среде из амфотерных гидроксидов Al(OH)3, Cr(OH)3, Zn(OH)2 образуются комплексные гидроксиды Na[Al(OH)4, Na3[Cr(OH)6], Na2[Zn(OH)4]
всех солей растворимых в воде – практически полностью, из них:
средних солей Al2(SO4)3 = 2Al3+ + 2SO42–
кислых солей ступенчато, в основном по 1 ступени
NaHCO3 = Na+ + HCO3– (первая ступень)
HCO3– = H+ + CO32– (вторая ступень)
основных солей ступенчато, в основном по 1 ступени
CuOHCl = CuOH+ + Cl– (первая ступень)
CuOH+ = Cu+2 + OH– (вторая ступень)
двойных солей KAl(SO4)2 = K+ + Al3+ + 2SO42–.
комплексных солей Na2[Zn(OH)4] = 2Na+ + [Zn(OH)4)]2–.
Степень диссоциации (α) – отношение числа молекул электролита распавшихся на ионы к общему числу его молекул в растворе. Понятие степени диссоциации неприменимо к сильным электролитам.
Электролиты – вещества, которые в расплавах или растворах в заметной степени распадаются на ионы (положительные катионы и отрицательные анионы) и проводят электрический ток (проводники второго рода, ионная проводимость).
Неэлектролиты– не распадаются на ионы, их растворы не проводят ток.
Сильные электролиты – вещества, диссоциирующие в растворах полностью:
| сильные кислоты | HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4 |
| Щелочи | NaOH, KOH, LiOH, RbOH, Ba(OH)2, Ca(OH)2 |
| Соли | Все растворимые в воде |
Слабые электролиты – вещества, диссоциирующие частично, в их растворах устанавливается равновесие между молекулами и ионами.
a<3% Н2О, СН3СООН, H2C2O4;
a=3÷30% – кислоты H2CО3, H2SО3, HNO2, CH3CООH, гидроксиды аммония NH4OH и металлов, кроме щелочей.
О силе электролита судят по электропроводности его растворов и по химической активности в реакциях: чем выше электропроводность и активнее участие в реакциях, тем больше ионов в растворе и тем выше сила электролита.
Сила оснований и кислот связана со степенью их диссоциации. Сильные основания и кислоты имеют высокую степень диссоциации (α≈1), образуют в растворе много ионов, поэтому являются сильными электролитами (хорошо проводят ток) и активно взаимодействуют в химических реакциях. Слабые основания и кислоты – диссоциируют в незначительной степени (α«1), являются слабыми электролитами (плохо проводят ток), не активно ведут себя в реакциях.
Не следует путать понятия «сила» и «растворимость» оснований и кислот. Например, гидроксид аммония NH4OH растворим в воде но не является щелочью, это слабое основание, в растворе находится преимущественно в виде недиссоциированных молекул, неактивно реагирует с кислотами. Гидроксид кальция Са(ОН)2 – плохо растворим в воде, но перешедшие в воду молекулы полностью диссоциированы, Са(ОН)2 активно реагирует с кислотами и является сильным основанием. Гидроксид кальция, вернее его растворенная в воде часть (тривиальное название известковая вода) является щелочью.
Следует напомнить, что сказанное выше о диссоциации относится к растворам электролитов. Количество ионов труднорастворимых сильных электролитов, таких как многокислотные основания Mg(OH)2, Са(OH)2 и солей ВаSO4, СаСО3, в растворах мало и зависит от ПР этих соединений.
Константа диссоциации (Кдис) – константа равновесия процесса диссоциации, количественная характеристика слабых электролитов, не зависит от концентрации раствора.
NH4OH ⇄ NH4++ OH– 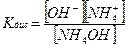
Показатель константы диссоциации: PК = – lg Кдис.
Закон разбавления Оствальда связывает константу и степень диссоциации:
 , где
, где  , См - молярная концентрация
, См - молярная концентрация
Если α значительно меньше 1, уравнение закона Оствальда упрощается:
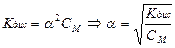 .
.
Для бинарного слабого электролита
[К+]=[Аn–]= 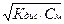 .
.
Например: для слабого основания NH4OH
[NH4+]=[OH–]= 
для слабой кислоты НСlO
[H+]=[СlO–]= 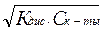
Изменение условий смещает равновесие процесса диссоциации:
разбавление раствора усиливает диссоциацию,
добавка одноименного иона, (т.е. увеличение концентрации одного из ионов) подавляет диссоциацию электролита.
Пример 1Напишите уравнение электролитической диссоциации муравьиной кислоты и найдите концентрацию ионов Н+ и НСОО- в водном растворе, молярность которого составляет См=0,01моль/л, а константа диссоциации Кдис =1,810-4.
Решение
Муравьиная кислота – слабая кислота. В водном растворе присутствуют в основном молекулы HCOOH и некоторое количество ионов, образовавшихся в результате диссоциации.
При диссоциации из одной молекулы образуется один ион H+ и один ион HCOO–.
HCOOH 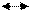 H+ + HCOO–, т.е. СH+ = СHCOO–
H+ + HCOO–, т.е. СH+ = СHCOO–
Концентрацию ионов найдем из упрощенного выражения закона Оствальда.
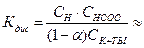

СH+ = СHCOO–= 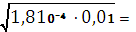 1,34
1,34 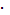 10-3моль/л.
10-3моль/л.
Дата добавления: 2019-12-09; просмотров: 606;











