Фазовое равновесие.
Линия равновесия. Рассмотрим в качестве примера процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой, т. е. в виду отсутствия равновесия переходит из газовой фазы Фу, где его концентрация равна У, в жидкую фазу Фх, имеющую начальную концентрацию Х = 0.
С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью, пропорциональной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равны друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу.
При равновесии достигается определенная зависимость между предельными, или равновесными, концентрациями распределяемого вещества в фазах для данных температуры и давления, при которых осуществляется процесс массопередачи.
В условиях равновесия некоторому значению Хотвечает строго определенная равновесная концентрация в другой фазе, которую обозначим через У*. Соответственно концентрации Уотвечает равновесная концентрация Х*. В самом общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается зависимостью:
У* = f(X) (3.1)
или
X* = j (У) (3.2)
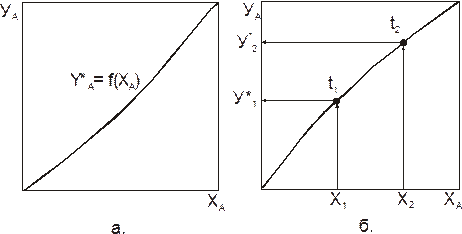
Любая из этих зависимостей изображается графически линией равновесия, которая либо является кривой, как показано на рисунке 3.1, либо в частном случае - прямой линией. На рисунке 3.1а показана равновесная кривая для системы с компонентами-носителями, выражающая зависимость равновесной концентрации, например в газовой фазе, от концентрации жидкой фазы при Р = const и t = const. На рисунке 3.1 б приведен пример равновесной кривой для процесса ректификации, построенной при Р = const. Каждая точка кривой, как показано на рисунке соответствует разным температурам (t1, t2 и т. д.).
Отношение концентраций фаз при равновесии называется коэффициентом распределения:
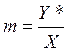 (3.3)
(3.3)
Коэффициент распределения выражает тангенс угла наклона линии равновесия и для кривой линии равновесия является величиной переменной.
Конкретный вид законов равновесного распределения, выражающих зависимости (3.1) и (3.2), различен для разных процессов массопередачи. Так, например, в процессе абсорбции при низких концентрациях распределяемого вещества в исходном растворе равновесие описывается законом Генри, для идеальных растворов в процессах ректификации - законом Рауля и т. д.
Зная линию равновесия для конкретного процесса и рабочие, т. е. неравновесные концентрации фаз в соответствующих точках, можно определить направление и движущую силу массопередачи в любой точке аппарата. На основе этих данных может быть рассчитана средняя движущая сила, а по ней - скорость процесса массопередачи.
|
| Рисунок 3.1. Примеры диаграмм равновесия: а – при Р= const и t=const; б- при Р= const. |
Дата добавления: 2021-11-16; просмотров: 650;











