Расчет процесса горения топлива в греющей камере
Температура сгорания топлива определяется из уравнения теплового баланса реакции горения, имеющего в общей форме вид:
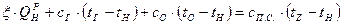 , (5.9)
, (5.9)
где 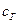 ,
,  и
и 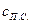 – теплоемкости соответственно горючего, окислителя и продуктов сгорания;
– теплоемкости соответственно горючего, окислителя и продуктов сгорания; 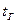 ,
, 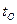 ,
, 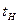 и
и 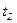 – температуры соответственно горючего, окислителя, начальная (принята одинаковой для окислителя и горючего) и температура горения топлива.
– температуры соответственно горючего, окислителя, начальная (принята одинаковой для окислителя и горючего) и температура горения топлива.
Уравнение (5.9) решается обычно итерационным методом, то есть задаются каким-либо значением 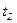 и проверяют условие выполнения теплового баланса.
и проверяют условие выполнения теплового баланса.
Энтальпия уходящих газов ( 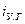 ) равна:
) равна:
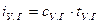 , (5.10)
, (5.10)
где 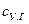 и
и 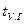 – соответственно средняя теплоемкость и температура уходящих газов.
– соответственно средняя теплоемкость и температура уходящих газов.
Суммарная теплоемкость продуктов горения определяется уравнением:
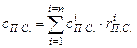 , (5.11)
, (5.11)
где 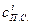 и
и 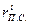 – теплоемкости при температуре горения и объемные доли составляющих продуктов горения, n – число продуктов, индекс i характеризует конкретный продукт.
– теплоемкости при температуре горения и объемные доли составляющих продуктов горения, n – число продуктов, индекс i характеризует конкретный продукт.
В состав жидких и твердых топлив входят горючие элементы и негорючие примеси (балласт). К горючим относятся углерод (C), водород (H) и горючая (летучая) сера (SЛ). Часть серы образует в топливе сложные соединения с внутренним балластом (кислородом и азотом) и не участвует в реакции горения. Кроме того, в топливе присутствует внешние примеси: зола (А) и влага (W). Поэтому для топлив различают органическую, горючую, сухую и рабочую массу топлив. Органическая масса включает в себя углерод, водород, кислород и азот (соответствующий массовый состав обозначают  ,
, 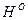 ,
,  и
и 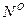 ). Горючая масса в дополнение к органической включает горючую серу (соответствующий состав обозначают
). Горючая масса в дополнение к органической включает горючую серу (соответствующий состав обозначают  ,
, 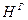 ,
,  ,
, 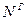 и
и 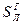 ). Сухая масса помимо горючей включает в себя золу (состав обозначают как
). Сухая масса помимо горючей включает в себя золу (состав обозначают как  ,
, 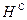 ,
, 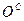 ,
, 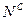 ,
,  и
и 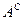 ). Рабочая масса характеризует полный состав горючего (
). Рабочая масса характеризует полный состав горючего (  ,
, 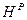 ,
, 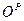 ,
, 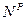 ,
, 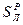 ,
, 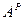 и
и 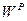 ). Соотношения между рассматриваемыми составами сведены в табл. 8.
). Соотношения между рассматриваемыми составами сведены в табл. 8.
Зная состав горючего, можно теоретически определить теплоту его сгорания. Для твердых и жидких топлив при этом используется формула Д.И. Менделеева:
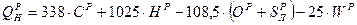 (5.12)
(5.12)
Для газообразных горючих расчет проводится по составу сухого горючего. Теплота сгорания может быть приближенно определена как сумма произведений теплот сгорания отдельных горючих газов (уменьшенных в 100 раз) на объемное содержание этих газов в смеси, выраженное в процентах:
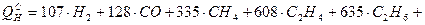
 (5.13)
(5.13)
Для газов характерных газовых месторождений эти данные сведены в таблицы (см. например, табл. 3, 7).
Табл. 8
Соотношения между различными способами представления состава горючего
| Заданная масса | Искомая масса: | |||
| органическая | горючая | сухая | рабочая | |
| Органическая | – | 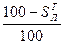
| 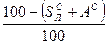
| 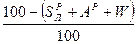
|
| Горючая | 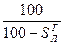
| – | 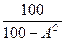
| 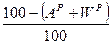
|
| Сухая | 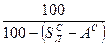
| 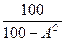
| – | 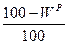
|
| Рабочая | 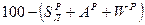
| 
| 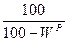
| – |
Для известного состава горючего легко рассчитывается и количество кислорода или воздуха, теоретически необходимого для обеспечения полного сгорания горючего. Расчет проводится с использованием стехиометрических уравнений, описывающих процессы горения отдельных компонентов газовой смеси, представленных в табл. 9.
Табл. 9
Характеристики основных реакций, протекающих при горении газообразного топлива
| Газ | Реакция | Тепловой эффект реакции при 0 оС, кДж/м3 | |
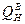
| 
| ||
| Водород | H2+0,5O2=H2O | 12 760 | 12 760 |
| Окись углерода | CO+0,5O2=CO2 | 12 680 | 12 680 |
| Метан | CH4+2O2= CO2+2H2O | 39 792 | 39 792 |
| Ацетилен | C2H2+2,5O2= 2CO2+H2O | 58 052 | 58 052 |
| Этилен | C2H4+3O2= 2CO2+2H2O | 63 047 | 63 047 |
| Этан | C2H6+3,5O2= 2CO2+3H2O | 69 713 | 69 713 |
| Пропан | C3H8+5O2= 3CO2+4H2O | 99 219 | 99 219 |
| Бутан | C4H10+6,5O2=4CO2+5H2O | 128 608 | 128 608 |
| Сероводород | H2S+1,5O2= SO2+H2O | 25 425 | 25 425 |
Дата добавления: 2021-11-16; просмотров: 520;











