Механизмы защиты живых организмов от деструктивного действия ультрафиолета. Фотреактивация, фотозащита.
В процессе биохимической эволюции у живых систем сформировались специфические механизмы, направленные на повышение устойчивости клеток к повреждающему действию ультрафиолетовых лучей. К настоящему времени известны два таких процесса – фотореактивация и фотозащита.
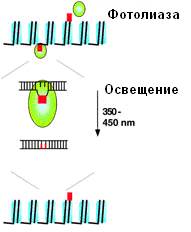
Фотореактивация – биологический процесс, направленный на устранение УФ-индуцированных летальных фотопродуктов нуклеиновых кислот. В этом процессе участвует специальный фоточувствительный фермент фотолиаза, строго специфичный к пирмидиновым димерам. Этот фермент выделен из многих биологических объектов. Известны природа хромофорных групп у двух фотолиаз: бактериальной и дрожжевой. У бактериальной фотолиазы хромофорная группировка представлена восстановленной молекулой ФАД с максимумом поглощения при 380 нм. Хромофорная часть дрожжевой фотолиазы является производным диазофлавина с максимумом поглощения, в зависимости от значения рН, от 375 до 420 нм. Ферментативный гидролиз димеров происходит только под воздействием света, т.е. фотолиазы работают в возбужденном состоянии. Предполагается, что при этом процессе происходит перенос электронов от молекулы фермента к субстрату. Это подтверждается данными об ингибировании процесса фотореактивации активными акцепторами электронов, например, KNO3, KCl.
Эффект фотозащиты заключается в том, что предварительное облучение клеток длинноволновым спектром ультрафиолета или видимым светом приводит к значительному повышению их устойчивости к деструктивному действию коротковолновых лучей. Проявление такого эффекта показано на клетках микроорганизмов (бактерий, дрожжевых клеток) и на культуре клеток многоклеточных организмов. Наибольший эффект фотозащиты проявляется при действии света в интервале 310 - 350 нм. Для проявления эффекта фотозащиты необходим определенный промежуток времени между действием длинноволнового и коротковолнового света. За это время в клетках происходит синтез защитных соединений (протекторов), таких как 5-окситриптамин (серотонин). Предполагается, функция этих защитных агентов заключается в связывании их с молекулой ДНК, что уменьшает выход УФ-индуцированных димеров. Экспериментально показано, что предварительное введение протекторов в клетки значительно повышает их устойчивость к действию ультрафиолетового света.
Фотосенсибилизация. Многие организмы содержат природные пигменты, поглощающие энергию света определенных длин волн, что придает им повышенную чувствительность к действию солнечного света. Такая высокая фоточувствительность может приводить к повреждениям клеток, тогда как клетки не содержащие этих пигментов светом не повреждаются. Фотосенсибилизаторы могут быть эндогенные, т.е. синтезироваться в клетках и экзогенные, когда они вносятся в клетки извне. Известны 4 класса соединений естественного происхождения, вызывающих фотосенсибилизирующий эффект: гиперицины, хлорофиллы, порфирины и псоралены.
Гиперицины получили свое название от рода растений, в экстрактах которых были впервые обнаружены: зверобой (Hypericium). Собственно гиперицин представляет собой соединение c формулой C30H16O8 , состоящее из восьми ароматических колец с восемью гидроксильными группами (рис.2). Другие соединения этой группы вместо гидроксильных групп могут содержать метильные группы(например, псевдогиперицин). Гиперицины являются фотоокислительными сенсибилизаторами и в присутствии кислорода они являются причиной гибели клеток при действии интенсивного солнечного света.
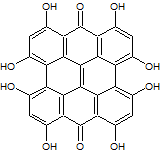
| |
| Рис. 2. Структурная формула гиперицина | |
Порфирины - циклические соединения, состоящие из четырех пиррольных колец, соединенных метиновыми мостиками (цикл порфина) (Рис.3). К порфиринам относятсятакие важные пигменты. как гемоглобины, хлорофиллы. Они входят также в состав молекул окислительно-восстановительных ферментов у аэробных клеток (цитохромы, каталазы, пероксидазы и др).
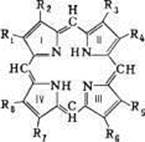
Порфирин: R1=R2=R3=R4=R5=R6=R7=R8=H
Протопорфирин: R1=R3=R5=R8=CH3; R2=R4=—CH=CH2; R6=R7=C2H4COO H
Уропорфирин: R1=R3=R5=R8=CH2COOH; R2=R4= R6=R7=C2H4COOH
Рис. 3. Структурная формула порфина - «скелета» молекул порфиринов
Хлорофиллы. Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях, водорослях, сине-зелёных водорослях (цианобактериях), фотоавтотрофных простейших и фотоавтотрофных бактериях и обуславливают фотодинамический эффект у мутантных растительных клеток с дефицитом каратиноидов.
Формально хлорофиллы представляют собой производные порфина, молекулы которых содержат циклопентаноновое кольцо, конденсированное с порфириновым макроциклом, центральный атом Mg и различные заместители; одно или два пиррольных цикла в молекулах частично гидрированы. В пиррольном кольце D к остатку пропионовой кислоты обычно присоединены остатки высокомолекулярных изопреноидных спиртов, которые придают хлорофиллам способность встраиваться в липидные слои мембран хлоропластов. 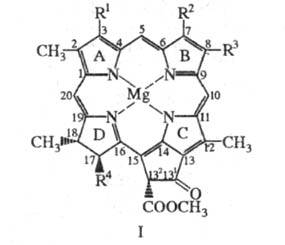
Рис.4. Структурная формула хлорофиллов: хлорофилл a: (R1 = СН — СН2, R2 = СН3, R3 = С2Н5, R4 = CH2CH2C(0)Y); хлорофилл b: (R1 = СН = СН2, R2 = СНО, R3 = C2H5, R4 = CH2CH2C(O)Y ); хлорофилл d: (R1 = СНО, R2 = СН3, R3 = С2Н5, R4 = CH2CH2C(O)Y).
Псоралены представляют собой трициклические соединения, являющиеся спаренными кумаровыми и фурановыми кольцами. Они присоединяясь к пиримидинам, повышают фоточувствительность молекул ДНК.
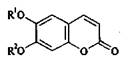
Рис. 5. Кумарин (R1 = R2 = Н) и его производные: умбеллиферон (R1 = Н, R2 = ОН ); эскулетин (R1 = R2 = ОН) ; скополетин (R1 = ОСН3 R2 = ОН);
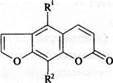
Рис. 6. Псорален ( R1 = Н R2 = Н) и его производные: ксантотоксин ( R1 = Н R2 = ОСНз); бергаптен (R1 – OCH3 R2 = Н) ; изопимпинеллин (R1 – ОСН3 R2 = ОСН3)
3.2. Производные ангелицина:
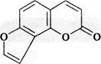
ангелицин
4. Пиранокумарины:
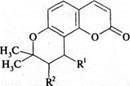
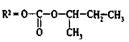
виснадин
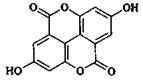
5. 3,4-бензокумарины:
 Фотореактивация
Фотореактивация
· Репарация ДНК
Абсорбция энергии УФ излучения молекулами ДНК приводит к образованию различных типов повреждений. Хотя одно- и двуцепочечные разрывы, а также ДНК-белковые сшивки могут возникать, большая часть индуцированных УФ-излучением повреждений приходится на модификацию азотистых оснований, с образованием циклобутан пиримидиновых димеров (CPD) и пиримидин-пиримидоновых фотопродуктов (6-4PP), как наиболее часто встречающихся типов фотоповреждений.
Пиримидиновые димеры являются ингибиторами и для репликации, и для транскрипции, что замедляет рост и приводит к мутагенезу в процессе репликации ДНК, если такие повреждения остаются неотрепарированными.
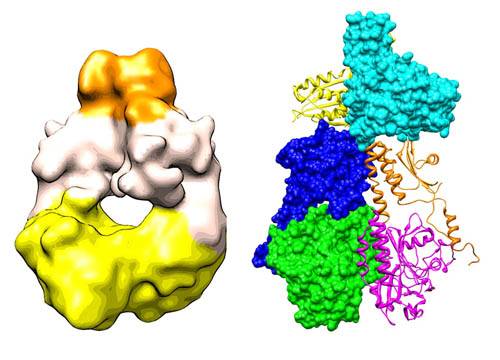
Для удаления индуцированных светом повреждений в ДНК у многих организмов применяются ферменты, специфично связывающиеся с CPD (CPD-фотолиаза) или с 6-4PP (6-4PP-фотолиазы) и исправляющие эти повреждения. CPD-фотолиазы обнаружены в бактериях, грибах, растениях, беспозвоночных и во многих позвоночных, 6-4PP-фотолиазы обнаружены, пока, только в Drosophila, тутовом шелкопряде, Xenopus laevis и в гремучих змеях, но не у Escherichia coli или дрожжей. У людей не обнаружено фотолиаз. Фотолиазы содержат FAD как каталитический кофактор и дополнительный хромофор в качестве светособирающей антенны.
Дополнительные хромофоры – это или 5,10-метенилтетрагидрофолат (MTHF), или 8-гидрокси-5-деазорибофлавин (8-HDF), с максимумами поглощений на длинах волн 380 и 440 нм, соответственно. Кристаллические структуры CPD-фотолиаз E.coli и Anacystis nidulans подтверждают, что для связывания с ДНК ферменты поворачивают пиримидиновый димер из дуплекса в углубление, содержащее каталитический кофактор. Затем циклобутановое кольцо расщепляется в ходе переноса, индуцированного светом электрона. CPD-фотолиазы селективно распознают CPD, подобно ДНК-связывающим белкам. Белый свет или UV-B-излучение индуцируют экспрессию CPD-фотолиаз. В отличие от CPD-фотолиаз, 6-4PP-фотолиаза стабильно экспрессируется и не регулируется ни белым светом, ни UV-B-излучением.
Дата добавления: 2018-05-10; просмотров: 1122;











