Практические применения
Одним из основных биофизических применений ИК-ПФ является определение структуры и конформационных изменений белков и ДНК. В некоторых случаях удается выявить взаимодействия на уровне отдельных аминокислотных остатков.
ИК-ПФ с изотопным мечением особенно полезен для структурного анализа специфических районов макромолекул (рис.8.). Например, в опытах по изотопному обмену на основании 50 000 колебаний белка в комплексе АТФ-азы с фосфатом кальция трифосфатного остатка были выявлены три растягивающих колебания фосфатной группы .
Времяразрешающая пошагово-сканирующая ИК-ПФ-спектроско-пия позволяет отслеживать конформационные изменения белков в микросекундном масштабе времени.
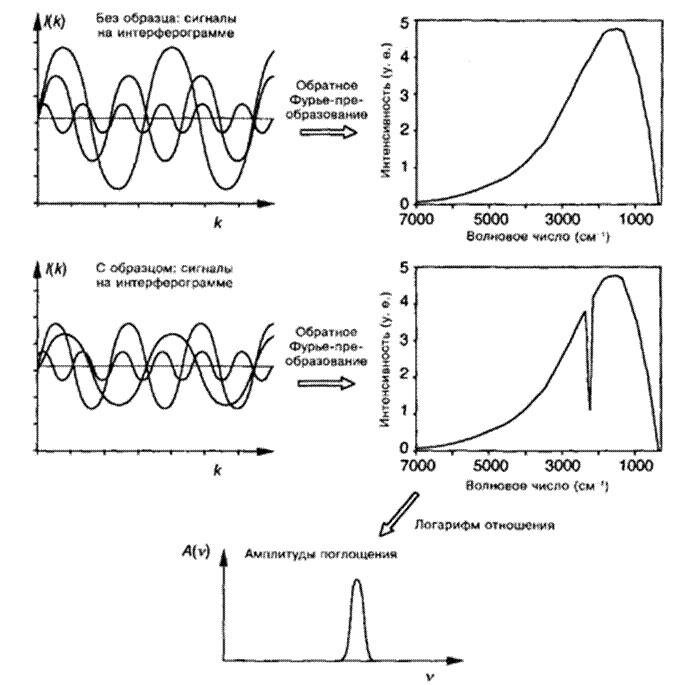 Рис.6. Принцип действия ИК-ПФ-спектрометра. Интерференция ИК-излучения регистрируется детектором для кюветы, заполненной растворителем, и для кюветы, заполненной раствором образца. Обратное Фурье-преобразование двух интерферограмм дает их И К-интенсивности. Спектр ИК-поглощения вычисляется с использованием логарифма отношения интенсивностей.
Рис.6. Принцип действия ИК-ПФ-спектрометра. Интерференция ИК-излучения регистрируется детектором для кюветы, заполненной растворителем, и для кюветы, заполненной раствором образца. Обратное Фурье-преобразование двух интерферограмм дает их И К-интенсивности. Спектр ИК-поглощения вычисляется с использованием логарифма отношения интенсивностей.
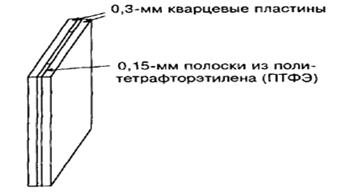 Рис.7. Кювета для образца в экспериментах по ИК-ПФ. Прозрачные стенки кюветы сделаны из кварцевых пластин.
Рис.7. Кювета для образца в экспериментах по ИК-ПФ. Прозрачные стенки кюветы сделаны из кварцевых пластин.
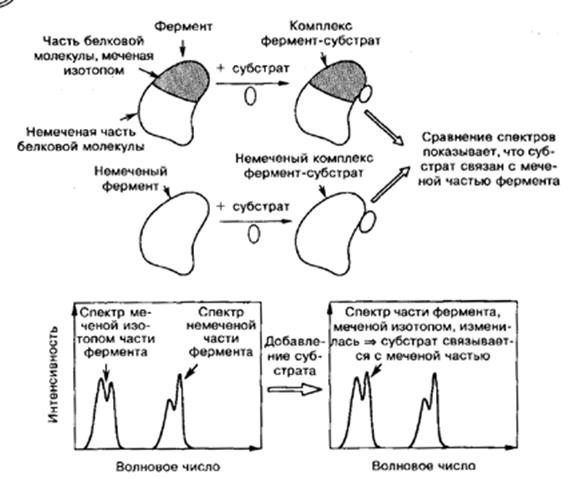
Рис.8.ИК-ПФ-спектроскопия с изотопным мечением. Поскольку спектр той части белковой молекулы, которая помечена изотопом, получается существенно смещенным, его можно отличить от спектра немеченой части. Изменение ИК-спектра белка при присоединении субстрата показывает, к какой части молекулы он присоединен. В данном примере высота пика в спектре меченой изотопом части белка изменилась при связывании с субстратом. Это показывает, что субстрат связывается с этой меченой частью фермента.
1.
Дата добавления: 2018-05-10; просмотров: 824;











