Равновесие при кристаллизации.
Растворимость вещества в жидких растворителях зависит от химической природы, свойств растворителя, Т и Р. Растворители- вода, спирты, углеводороды и другие. С увеличением Т растворимость большинства веществ увеличивается (рис.7.1). При понижении Т такие растворы становятся пересыщенными и переходят в состояние неустойчивого равновесия. Переход из неравновесного состояния в равновесное сопровождается выпадением кристаллов.
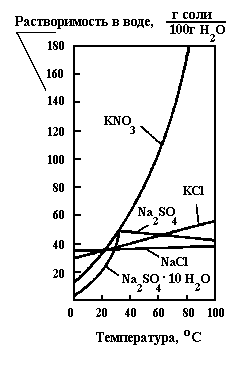
Рис.7.1 Кривые растворимости в воде (KNO3; NaCl; KCl; Na2SO4; Na2SO4*10H2O).
Растворимость определяет условия равновесия между кристаллами и раствором. Равновесие можно представить в виде диаграмм в координатах температура - состав (рис.7.2).
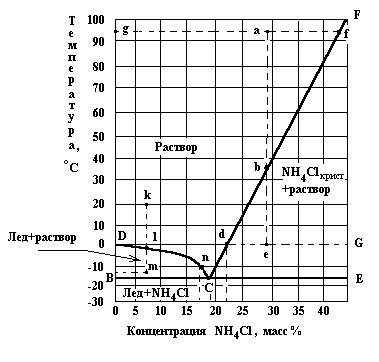
Рис.7.2. Диаграмма растворимости системы NH4Cl-H2O.
На этой диаграмме линия СF соответствует насыщенным растворам соли (линия растворимости), СD - растворам, находящимся в равновесии со льдом (вода в кристаллическом состоянии). В точке С, называющейся криогидратной, существует три фазы: раствор, кристаллы соли и лед. Область СFЕ ограничивает область пересыщенных растворов, т.е. растворов в которых концентрация выше растворимости. При некоторых условиях, рассматриваемых ниже, концентрация растворенного вещества может быть больше его растворимости. Такие растворы называются пересыщенными. Область CFE называется полем кристаллизациисоли и определяет пересыщенные растворы и механические смеси насыщенного раствора и избытка кристаллической соли.
Точки на диаграмме, расположенные выше линии DС и СF показывают состав ненасыщенных растворов.
Область ВСD называется полем кристаллизации льда, а точки в этой области характеризуют механическую смесь раствора с избытком льда.
Ниже линии ВСЕ находятся точки, отражающие состав твердой фазы, состоящей из кристаллов NH4Cl и льда (жидкая фаза отсутствует).
Диаграммы состава системы (рис.7.2) позволяют графически проводить расчеты процессов изотермического испарения растворов и кристаллизации при охлаждении.
На рис.7.3 показана зависимость концентрации, соответствующей условиям растворимости (кривая 1) и пересыщения (кривая 2) данного вещества от температуры.
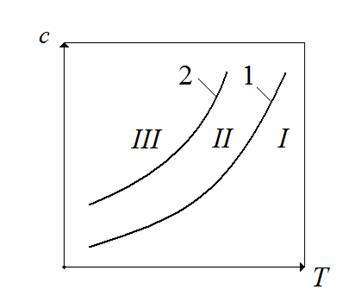
Рис.7.3. Зависимость равновесной концентрации и пересыщения от температуры.
На этом рисунке можно выделить при области. Область I Соответствует состоянию раствора до насыщения, кристаллизация в этой области не происходит.
Область II – относительно устойчивая (метастабильная) область; область III – неустойчивая (лабильная) область. Пересыщенные растворы III области кристаллизуются очень быстро, почти мгновенно. В метастабильной области пересыщенные растворы какое-то время остаются без существенных изменений, происходит только рост кристаллов, уже имеющихся в растворе. Следует отметить, что граница между II и III областями условна.
Кристаллизация идет с достаточной скоростью лишь в III области. В первый (инкубационный) период образуется зародыши кристаллов. Причиной образования зародышей кристаллов в растворах является флуктация концентраций, образование скопление молекул растворенного вещества. В случае столкновения друг с другом такие скопления могут укрепляться. Начиная с критического радиуса 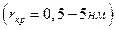 начинается быстрый рост зародышей и образование большого числа кристаллов.
начинается быстрый рост зародышей и образование большого числа кристаллов.
Способы кристаллизации могут быть изображены на диаграмме с – Т (рис.7.4).
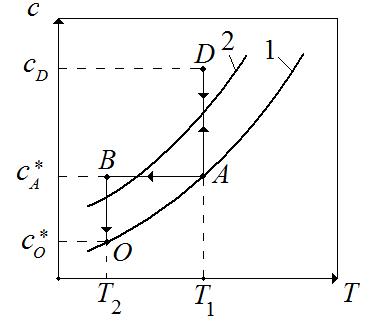
Рис.7.4. Изображение способов кристаллизации на диаграмме растворимости: 1 – кривая растворимости (насыщения), 2 – кривая пересыщения.
Предположим, что исходная смесь доведена до насыщения и характеризуется точкой А на диаграмме с параметрами 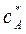 и
и 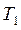 .
.
Изотермическая кристаллизация проводится удалением растворителя путем выпаривания раствора. При этом концентрация раствора увеличивается и раствор достигает лабильной области (точка D). После окончания процесса кристаллизации остается маточный раствор. Как известно, маточный раствор – насыщенный раствор и характеризуется точкой А. При этом концентрация раствора уменьшается с 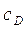 до
до 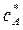 . В метастабильной области идет рост уже образовавшихся кристаллов. Итак, изотермическая кристаллизация характеризуется линиями AD и DA.
. В метастабильной области идет рост уже образовавшихся кристаллов. Итак, изотермическая кристаллизация характеризуется линиями AD и DA.
Изогидрическая кристаллизация проводится путем охлаждения раствора от 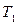 до
до 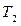 . При этом точка B находиться в лабильной области. Конечный маточный раствор характеризуется точкой О с параметрами
. При этом точка B находиться в лабильной области. Конечный маточный раствор характеризуется точкой О с параметрами 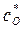 и
и 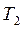 . Итак, изогидрическая кристаллизация характеризуется на диаграмме линиями АВ и ВО.
. Итак, изогидрическая кристаллизация характеризуется на диаграмме линиями АВ и ВО.
Выбор того или иного метода кристаллизации зависит от свойств растворителя и выделяемого вещества. Для веществ, растворимость которых уменьшается с понижением температуры, кристаллизацию целесообразно проводить изогидрических методом. В противном случае применяется изотермическая кристаллизация.
Дата добавления: 2018-05-10; просмотров: 1293;











