Равновесие при адсорбции.
Что такое АДСОРБЦИЯ
Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пар твердого тела - адсорбента. Поглощаемое вещество, находящееся в газе, паре называется адсорбтивом, а поглощенное - адсорбатом.
Адсорбцию подразделяют на два вида: физическую и химическую.
Физическая адсорбция обусловлена поверхностными вандервальсовыми силами, удерживающими на поверхности адсорбента несколько слоев молекул адсорбата.
При химической адсорбции поглощаемое вещество вступают в химическое взаимодействие с адсорбентом с образованием на его поверхности химических соединений.
Силы притяжения возникает на поверхности адсорбента благодаря тому, что силовое поле поверхностных атомов и молекул не уравновешено силами взаимодействия соседних частиц. Заполнение адсорбатом поверхности адсорбента частично уравновешивает поверхностные силы и уменьшает поверхностное натяжение. Это в конечном счете приводит к выделению тепла. Следовательно, процессы адсорбции экзотермичны.
Процессы адсорбции избирательны и обратимы (десорбция).
Адсорбция – применяется в главным образом при небольших концентрациях поглощаемого вещества в исходной смеси, когда требуется достичь практически полного извлечения адсорбтива. В тех случаях, когда концентрация извлекаемого вещества в исходной смеси велика, обычно выгоднее использовать абсорбцию.
Частным случаем хемосорбции является ионный обмен между твердым ионообменным сорбентом и раствором электролита. Кинетика, а также аппаратурное оформление ионообменных процессов близки к адсорбционным.
Адсорбенты.
Адсорбенты - пористые тела, обладающие большим объемом микропор. В адсорбентах основное количество поглощенного вещества сорбируется на стенках микропор (r< 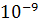 м). Количество остальных пор, более крупных, сводится к транспортированию адсорбтива к макропорам.
м). Количество остальных пор, более крупных, сводится к транспортированию адсорбтива к макропорам.
Поглотительная (адсорбционная) способность адсорбентам- максимально возможная концентрация адсорбтива в единице массы или объема адсорбента. Максимально возможную в данных условиях поглотительная способность адсорбента называют равновесной активностью.
Статическая активность (Аст)- количество вещества, поглощенного единицей массы адсорбента от начало до равновесия при статических условиях, динамическая активность (Адин) - при движении смеси через слой адсорбента. Как показывают эксперименты Аст > Адин . Однако расчеты ведут по Адин.
По химическому составу адсорбенты можно разделить на углеродные и не углеродные.
Углеродные - активные угли, углеродные волокнистые материалы, некоторые виды твердого топлива.
Удельная поверхность активных углей очень высока и составляет (6 ÷17)· 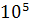
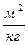 . Недостаток активных углей их горючесть.
. Недостаток активных углей их горючесть.
Неуглеродные – силикагели, активный оксид алюминия, алюмогели, цеолиты, глинистые породы.
Удельная поверхность селикагеля составляет - (4÷8)· 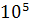
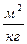 , алюмогели - до
, алюмогели - до
4 · 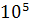
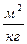 .
.
Глинистые породы применяют для очистки жидкостей от различных примесей.
Равновесие при адсорбции.
Равновесная концентрация 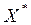 (
( 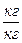 чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена:
чистого адсорбента) поглощаемого вещества в адсорбенте может быть представлена:
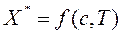 , (6.1)
, (6.1)
Или, в случае адсорбции газов:
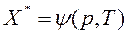 , (6.2)
, (6.2)
Здесь с – концентрация адсорбтива в объемной сплошной фазе, р– парциальное давление адсорбтива в объемной фазе. Зависимость 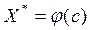 или
или 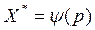 при T=const называется изотермой адсорбции.
при T=const называется изотермой адсорбции.
Равновесные зависимости описываются рядом эмпирических и теоретических уравнений. Одна из них уравнение Лангмюра:
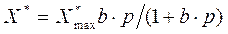 (6.4)
(6.4)
Здесь 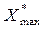 - предельная величина адсорбции, при полном заполнение внутренних пор мономолекулярным слоем адсорбата, b- константа, зависящая от температуры (рис.6.1)
- предельная величина адсорбции, при полном заполнение внутренних пор мономолекулярным слоем адсорбата, b- константа, зависящая от температуры (рис.6.1)
Изотермы адсорбции обычно определяются опытным путем.

Рис.6.1. Изотермы адсорбции: 1 – изотерма Лангмюра, 2,3,4 – реальные изотермы
(2 – линейная, 3 – вогнутая, 4 – выпуклая).
Адсорбция сопровождается уменьшением парциального давления поглощаемого компонента из газовой смеси и заметным выделением тепла. Поэтому количество адсорбированного вещества возрастает с понижением температуры и повышением давления (рис.6.2).
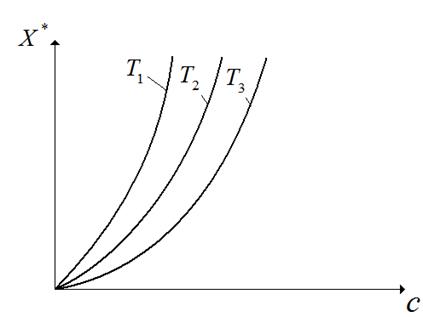
Рис.6.2. Изотермы адсорбции для одного вещества при различных температурах: 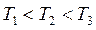 .
.
Дата добавления: 2018-05-10; просмотров: 1564;











