Процессы сжатия газа в идеальной компрессорной машине
В зависимости от условий теплообмена между сжимаемым газом
и окружающей средой теоретически возможны следующие процессы сжатия газа:
– процесс адиабатного сжатия, когда сжатие газа происходит
при отсутствии теплообмена с окружающей средой;
– процесс изотермического сжатия, когда изменение объема
и давления газа протекает при постоянной температуре (T = T1 = const);
– процесс политропного сжатия газа с частичным отводом тепла
в окружающую среду;
– процесс политропного сжатия газа с частичным подводом тепла извне.
Адиабатный процесс сжатия.Кривая сжатия соответствует уравнению адиабаты:
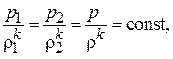 (7.5)
(7.5)
где 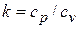 – показатель адиабаты,
– показатель адиабаты, 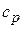 и
и 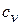 – теплоемкость газа
– теплоемкость газа
при постоянном давлении и при постоянном объеме соответственно.
Будем считать, что приращение кинетической энергии газа
по сравнению с потенциальной незначительно и вторым членом в правой части уравнения (7.4) можно пренебречь. Тогда совместное решение уравнений (7.4) и (7.5) дает:
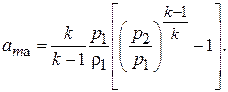 (7.6)
(7.6)
Используя уравнение состояния газа для начальных условий 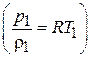 , выражение (7.6) можно представить в виде:
, выражение (7.6) можно представить в виде:
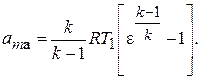 (7.7)
(7.7)
Из выражения (7.7) видно, что удельная работа адиабатного сжатия данного газа зависит лишь от его начальной температуры 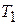 и степени повышения давления e.
и степени повышения давления e.
Определим температуру в конце сжатия 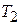 . Записав уравнение состояния газа для начала и конца процесса сжатия
. Записав уравнение состояния газа для начала и конца процесса сжатия 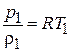 и
и 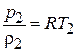 , получим:
, получим:
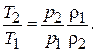 (7.8)
(7.8)
Выразив отношение плотностей из (7.5) как:
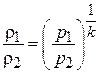
и подставив это отношение в (7.8), получим:
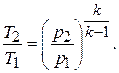 (7.9)
(7.9)
Ниже приводятся конечные температуры  адиабатического сжатия воздуха для различных e при начальной температуре воздуха
адиабатического сжатия воздуха для различных e при начальной температуре воздуха  К (по Цельсию 20 °C). Для воздуха k =1,4.
К (по Цельсию 20 °C). Для воздуха k =1,4.
| e | |||||||||
| T2, К | |||||||||
| T2, °C |
Изотермический процесс сжатия газа.Сжатие газа происходит
в соответствии с уравнением изотермы:
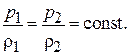 (7.10)
(7.10)
Совместное решение уравнений (7.4) и (7.10) дает:
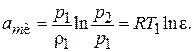 (7.11)
(7.11)
Как видно из (7.11), удельная работа изотермического сжатия данного газа зависит от его начальной температуры и степени повышения давления e.
Политропный процесс сжатия газа с частичным отводом тепла.В этом случае кривая сжатия проходит между кривыми адиабатического
и изотермического процессов сжатия газа, следуя уравнению политропы:
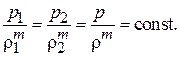 (7.12)
(7.12)
Здесь m – показатель политропы, значение которого определяется соотношением:
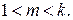
Формулу для определения удельной работы политропного сжатия без учета сообщаемой газу кинетический энергии можно получить совместным решением уравнений (7.4) и (7.12). Тогда получим:
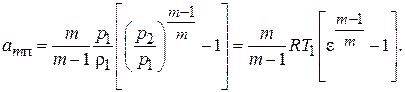 (7.13)
(7.13)
Следует отметить, что значение показателя политропы m будет постоянным в течение всего процесса сжатия лишь в том случае, когда отношение работы сжатия к количеству отводимого тепла всё время остается постоянным. В противном случае его значение будет меняться.
Политропный процесс сжатия с частичным подводом тепла извне.Сжатие происходит по политропе (7.12), но величина показателя политропы m больше, чем показателя адиабаты k.
Удельная работа политропного сжатия с частичным подводом
тепла извне может быть определена по формуле (7.13) с учетом соотношения 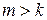 .
.
Рассмотрим сжатие газа на диаграмме  (рис. 7.2).
(рис. 7.2).
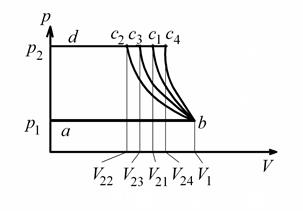
Рис. 7.2. Процессы сжатия газа на диаграмме 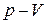
Кривая сжатия газа bc на диаграмме  может иметь различную крутизну в зависимости от вида процесса сжатия газа.
может иметь различную крутизну в зависимости от вида процесса сжатия газа.
С ростом интенсивности отвода тепла линия сжатия будет отклоняться от адиабаты (кривая bc1) влево, крайнее положение этой линии – bc2.
Линия bc2 соответствует изотерме, следовательно, всё выделяемое тепло отводится, и температура газа остается постоянной. Линия bc3 – линия политропного процесса сжатия газа с частичным отводом тепла (m < k), линия bc4 – кривая политропного сжатия газа с частичным подводом тепла извне (m > k).
Легко заметить, что расходуемая на сжатие газа работа имеет минимальное значение при изотермическом сжатии и максимальное –
при сжатии с частичным подводом тепла извне.
С ростом показателя кривой сжатия 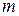 , согласно формуле (7.9), увеличивается температура газа в конце сжатия
, согласно формуле (7.9), увеличивается температура газа в конце сжатия 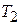 .
.
Дата добавления: 2018-05-10; просмотров: 2483;











