Закон Гесса и его следствия
Как было сказано ранее, внутренняя энергия и энтальпия системы не зависят от пути процесса и однозначно определяется параметрами начального и конечного состояния системы. Так как тепловые эффекты QV и QP равны соответственно разности внутренней энергии и энтальпии, то это означает, что тепловые эффекты изохорно-изотермических и изобарно-изотермических химических реакций также не зависят от пути процесса и однозначно определяются параметрами начального и конечного состояний химических реакций. На основании этого русским химиком Г.И. Гессом в 1840 г. был сформулирован закон химических реакций, который называется его именем.
Закон Гесса гласит, что тепловой эффект химической реакции равен сумме тепловых эффектов образования продуктов реакции за вычетом тепловых эффектов образования продуктов, вступающих в реакцию. При этом следует помнить, что тепловой эффект образования простых веществ равен нулю. Тепловой эффект химической реакции, состоящей из нескольких промежуточных стадий, не зависит от параметров состояния этих промежуточных стадий или их последовательности, а полностью определяется начальным и конечным состоянием системы. Так как для обратимых круговых процессы ∆U=0 и ∆I=0, то на основании закона Гесса следует, что для обратимых изохорно-изотермических и изобарно-изотермических химических реакций алгебраическая сумма тепловых эффектов равна нулю. Другими словами этот закон можно сформулировать так: тепловой эффект химической реакции равен теплоте образования исходных веществ за вычетом теплоты образования продуктов реакции.
Закон Гесса позволяет рассчитать тепловые эффекты химических реакций, которые экспериментально определить весьма сложно.
Из закона Гесса вытекает ряд очевидных следствий:
1. Тепловой эффект образования химического соединения из исходных веществ не зависит от способа, которым это соединение получено.
2. Тепловой эффект образования химического соединения из исходных веществ равен тепловому эффекту с обратным знаком разложения этого соединения до исходных продуктов.
3. Разность между тепловыми эффектами превращения одного вещества в два различных продукта равна тепловому эффекту превращения одного продукта в другой.
Если в реакцию вступает два или несколько горючих веществ и в результате реакции образуется новое горючее вещество, то третье следствие закона Гесса можно сформулировать следующим образом: тепловой эффект химической реакции двух горючих веществ равен алгебраической сумме теплот сгорания этих веществ за вычетом теплоты сгорания продуктов реакции, т.е.
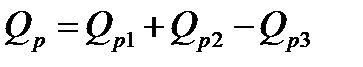
Уравнение Кирхгофа
При изохорно-изотермических реакциях работа расширения отсутствует, так как dV=0. При изобарно-изотермических химических реакциях работа расширения имеет место, так как в таких реакциях происходит изменение объема в результате изменение объема в результате изменения числа молей участников реакции. Следовательно, тепловые эффекты изохорно-изотермических и изобарно-изотермических химических реакций различны.
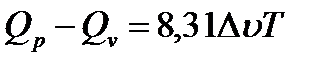
Таким образом,разность между тепловыми эффектами при изобарно-изотермических и изохорно-изотермических химических реакциях равна работе расширения, вызванной разницей между количеством молей иходных реагентов и продуктов изобарно-изотермических реакций. Разность Qp-Qvзависит. кроме того, и от температуры. Для установления этой зависимости рассмотрим характер изменения Qpи Qvот температуры.
Тепловой эффект изобарно-изотермической химической реакции при 0 К примет вид
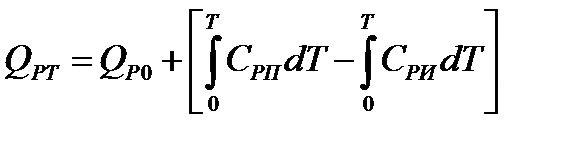
Это уравнение называется уравнением Кирхгофа. Оно определяет характер изменения тепловых эффектов изобарно-изотермических химических реакций в зависимости от температуры.
Аналогично для тепловых эффектов изохорно-изотермических реакций можно записать
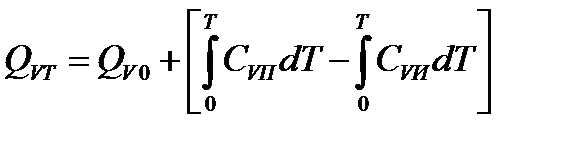
где CV– изохорная теплоемкость, Дж/(кг К).
Так как для горных пород, как и для всех твердых тел, изобарная СР и изохорная СVтеплоемкости практически одинаковы, то для них тепловые эффекты изобарно-изотермических и изохорно-изотермических химических реакций примерно одинаковы.
Дата добавления: 2018-05-10; просмотров: 1698;











