Термодинамические процессы.
Всякий термодинамический процесс может возникнуть только при нарушении механического или термического равновесия, т.е. при сжатии или расширении газа (давление среды больше или меньше давления газа), при нагреве или охлаждении газа (температура среды больше или меньше температуры газа). Чем сильнее нарушается равновесие, тем быстрее в общем случае проходит процесс и тем более резко будет нарушаться состояние покоя газа.
В ходе термодинамического процесса будут меняться равновесные параметры системы (тела), связь между которыми дается уравнением состояния f(p,V,T)=0, и внутренняя энергия, изменение которой можно определить по уравнению вида f(U, T, V)=0.
В термодинамике процессы, подчиненные закономерности, выражаемой условием φ=const, называются политропными (с греч. многообразными). Изменение параметров газа в политропном процессе, определяется величиной n, называемой показателем политропы и для каждого процесса она постоянна.
Исследование процессов при разных значениях n приводит нас к некоторым частным случаям политропных процессов, особо выделяемым при изучении:
- изобарный процесс (постоянное давление), показатель политропы равен 0;
- изотермический процесс (постоянная температура), показатель политропы равен 1;
- адиабатный процесс (процесс без обмена теплотой с окружающим пространством), показатель политропы равен постоянному числу;
- изохорный процесс (объем постоянен), показатель политропы равен множеству.
Свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту, называют – энтальпия.Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Энтальпию определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью преобразовать теплоту в работу при определенной температуре и давлении (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту.
H = U + pV
Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
Рассмотрим, что такое кпд тепловой машины
Термический коэффициент полезного действия
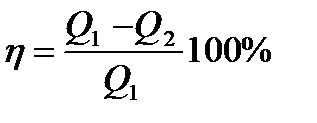
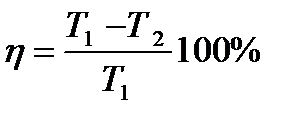
Если имеются различные циклические тепловые машины действующие между температурами Т1 и Т2 и если некоторые из этих систем обратимые, то к.п.д. всех систем одинаков, а необратимые будут иметь к.п.д. не превышающих к.п.д. обратимых систем.
Ничто, кроме силы трения, не мешает нам довести КПД простого механизма (рычага, блока, ворота и т.д.) до 100 %. Всю механическую энергию тела можно превратить во внутреннюю, во внутреннюю энергию самого тела и окружающих тел.
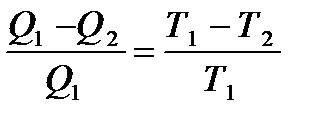
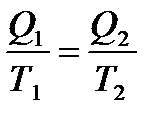
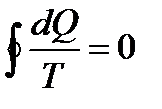
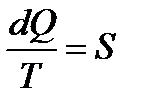 Дж/°С
Дж/°С
Данная величина называется энтрапия
Первое начало термодинамики, устанавливает существование у всякой равновесной системы однозначной функции состояния – внутренней энергии, которая не изменяется в отсутствии внешних воздействий при любых процессах внутри системы.
Второе начало термодинамики устанавливает существование у всякой равновесной системы другой однозначной функции состояния – энтропии, которая, однако, в отличие от внутренней энергии, не изменяется у изолированной системы только в равновесных процессах и всегда возрастает при неравновесных в ней процессах. Таким образом, второй закон термодинамики представляет собой закон об энтропии.
Можно объединить математические выражения первого и второго законов термодинамики в одном уравнении:
первый 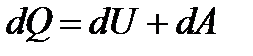
второй 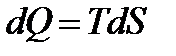
откуда получаем 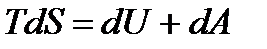
Это соотношение, охватывающее первый и второй законы термодинаки, называют термодинамическим тождеством. Все выведенные уравнения применимы для обратимых циклов и процессов.
Без внешнего воздействия процессы могут протекать только в том случае, когда энтропия постоянна (при обратимые процессы) или возрастает (необратимые процессы).
Невозможно построить машину, которая могла бы за счет теплоты от охлажденных тел превращала бы ее в работу.
Максимальное значение энтропии замкнутой системы достигается тогда, когда система приходит в состояние термодинамического равновесия. Такая количественная формулировка второго закона термодинамики дана Клаузиусом.
Переход из неравновесного состояния в равновесное представляет собой переход из состояния, которое может осуществляться меньшим числом способов, в состояние, осуществляемое значительно большим числом способов. Наиболее вероятным для замкнутой системы будет то состояние, которое осуществляется наибольшим числом способов, т.е. состояние теплового равновесия.
В то же время маловероятным был бы самопроизвольный выход системы из состояния равновесия. Число способов, которыми может быть осуществлено данное равновесное состояние, называется термодинамической вероятностью ω.
Число способов ω, которыми может осуществляться данное состояние системы, состоящие, например, из двух тел, равно произведению чисел способов ω1 и ω2, которыми могут быть осуществлены состояния каждого из этих тел в отдельности
ωсист=ω1ω2
Термодинамическая вероятность не связана с тепловыми характеристиками системы, а лишь с механическими.
При этом энтропия будет равна
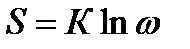
где К – универсальная газовая постоянная, отнесенная к одной молекуле и равна 1,38∙10-23 Дж/°С
К=R/NA
где R– газовая постоянная;
NA– число Авагарда.
Энтропия химически однородного тела конечной плотности при стремлении температуры к абсолютному нулю стремится к предельному значению, не зависящему от давления, плотности или фазы. Удобно поэтому принимать состояние при 0°К за некоторое начальное состояние и считать, что
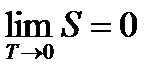
Данное уравнение носит название закона Нерста или третьего закона термодинамики.
Тогда энтропия произвольного состояния определяется однозначным образом. Найденую таким образом энтропию называют иногда абсолютной энтропией.
Термодинамическому состояниюсистемы при абсолютном нуле соответствует только одно термодинамическое состояние с наименьшей энергией совместимое с данной кристалической структурой или с данным агрегатным состоянием системы.
Дата добавления: 2018-05-10; просмотров: 1815;











