Термодинамическое рабочее тело, параметры состояния. Уравнение состояния.
Термодинамическое рабочее тело – тело, посредством которого тепловая энергия превращается в механическую и наоборот. В тепловых двигателях и машинах термодинамическим рабочим телом (ТРТ) является, как правило, газ или пар, что обусловлено тем, что газы, в отличие от жидких и твёрдых тел, могут значительно изменять свой объём при изменении температуры. В реальных условиях процесс превращения теплоты в работу достаточно сложен, поэтому в рабочее тело вводят ряд упрощающих его рассмотрение допущений и используют понятие идеального газа, отвечающего следующим условиям:
- Между молекулами идеального газа отсутствуют силы взаимодействия.
- Молекулы идеального газа не имеют геометрических размеров, т.е. объём молекул бесконечно мал по сравнению с межмолекулярным пространством.
- Столкновения молекул идеального газа между собой и с элементами ТС абсолютно упругие и происходят без потерь энергии на деформацию ТС и самих молекул.
Величины, характеризующие состояние ТРТ, называют термодинамическими параметрами состояния. Основными параметрами состояния ТРТ являются параметры, которые могут быть непосредственно измерены. Применительно к идеальному газу к ним относятся:
- абсолютное давление, P, Па;
- температура, T, К;
- удельный объём, v, м3/кг (или плотность, ρ, кг/м3).
Абсолютное давление в зависимости от давления в рабочем объёме может быть больше или меньше барометрического, но не может быть меньше 0, т.е. меньше значения, соответствующего абсолютному вакууму. Следует помнить, что термодинамическим параметром состояния является абсолютное, а не манометрическое или избыточное давление.
Температура. Согласно молекулярно-кинетической теории, между средней скоростью молекул газа и абсолютной температурой существует прямо-пропорциональная зависимость:
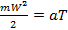 , (1)
, (1)
где a – коэффициент, одинаковый для всех газов. Отдельные молекулы могут иметь скорости, отличные от этого значения – как больше, так и меньше. Следует помнить, что понятие абсолютной температуры относится к среднестатистической скорости молекул, осреднённой по всей массе ТРТ.
Очевидно, что нуль абсолютной температуры соответствует нулевой средней скорости молекул, т.е. полному прекращению кинетического движения молекул, что маловероятно и труднодостижимо.
Следует отметить, что термодинамическим параметром состояния является абсолютная температура, измеренная по абсолютной температурной шкале Кельвина, а не по какой-либо иной.
Удельный объём. Если V – объём ТРТ, а G – его масса, то удельным объёмом называют объём единицы массы вещества: 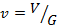 , м3/кг. Величина, обратная удельному объёму (масса единицы объёма), называется плотностью вещества –
, м3/кг. Величина, обратная удельному объёму (масса единицы объёма), называется плотностью вещества – 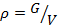 , кг/м3, т.е. vρ=1. В общем случае v и ρ являются функциями температуры и давления.
, кг/м3, т.е. vρ=1. В общем случае v и ρ являются функциями температуры и давления.
Величины p, v, T являются основными параметрами состояния, определяющими состояние тела, а их изменение непосредственно связано с тепловыми и механическими превращениями ТРТ. Параметры состояния взаимосвязаны и в общем случае при изменении одного из них изменяются и два других.
Уравнение состояния. Общая функциональная связь приведённых выше параметров в виде уравнения
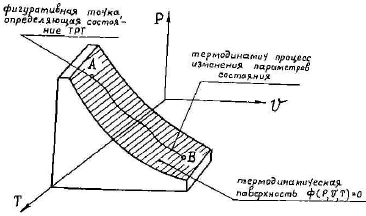
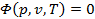 называется термодинамическим уравнением состояния вещества. Геометрически уравнение состояния можно трактовать как уравнение поверхности, которую называют термодинамической поверхностью, и любое состояние ТРТ изображается в виде точки на этой поверхности (рис.1). → → → → → → → →
Для описания уравнения состояния, характерного для идеального газа, воспользуемся известными из курса физики (точнее, из молекулярно-кинетической теории газов) законами Бойля-Мариотта и Гей-Люссака. называется термодинамическим уравнением состояния вещества. Геометрически уравнение состояния можно трактовать как уравнение поверхности, которую называют термодинамической поверхностью, и любое состояние ТРТ изображается в виде точки на этой поверхности (рис.1). → → → → → → → →
Для описания уравнения состояния, характерного для идеального газа, воспользуемся известными из курса физики (точнее, из молекулярно-кинетической теории газов) законами Бойля-Мариотта и Гей-Люссака.
| 
|
Согласно закону Бойля-Мариотта, произведение давления газа на его удельный объём при постоянной температуре есть величина постоянная:
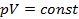
Согласно закону Гей-Люссака, объём газа при постоянном давлении изменяется прямо-пропорционально температуре, а, в свою очередь, давление газа при постоянном объёме также изменяется прямо-пропорционально температуре:
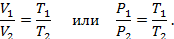
Объединением этих законов получено уравнение состояния газа, согласно которому произведение абсолютного давления на удельный объём прямо-пропорционально абсолютной температуре:
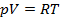 ,
,
где R – постоянная, зависящая от свойств газа. Для G кг газа – pv=GRT; для моля газа – pv=μRT, где μ – вес моля газа. Поскольку μR=Rун=8480, легко найти газовую постоянную для любого газа: H2 – 8480:2=4240; O2 – 8480:32=265; CO2 – 8480:44=189; воздух – 8480:29=287.
Эти уравнения справедливы только для идеального газа и только для его равновесного состояния.
Дата добавления: 2017-11-21; просмотров: 985;











