ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА.
К химическим источникам относятся гальванические элементы и аккумуляторы
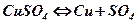
Электролитическая диссоциация – распад молекул на положительные и отрицательные ионы в электролите.
Электрический ток образуется благодаря действию встречных потоков заряженных частиц – потока положительных ионов, идущих к катоду, и потоке отрицательных ионов, идущих к аноду.
При прохождении электрического тока через растворы происходит процесс разложения электролита на составные части, сопровождаемый выделением химических веществ на электродах.
Простейших гальванический элемент – медно-цинковый гальванический элемент Вольта. Он состоит из двух пластин (электродов) – цинковой и медной, опущенных в водный раствор серной кислоты Н2SO4 , называемый электролитом.
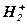 и
и 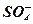 и растворение
и растворение 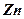 и
и 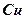 в серной кислоте.
в серной кислоте.
При растворении цинкового электрода положительные ионы цинка будут переходить в раствор, заряжая его положительно. При этом на цинковом электроде будут скапливаться свободные электроны, вследствие чего этот электрод приобретет отрицательный потенциал. Медный электрод тоже растворяется в растворе, но растворимость 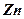 больше
больше 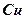 и поэтому будет разность потенциалов, которая называется ЭДС гальванического элемента. Она зависит от химического состава электролита и металлов, из которых выполнены электроды (1,3 – 1,5 В).
и поэтому будет разность потенциалов, которая называется ЭДС гальванического элемента. Она зависит от химического состава электролита и металлов, из которых выполнены электроды (1,3 – 1,5 В).
При подключении потребителя в электролите ионы 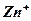 и
и 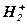 от цинковой пластины начнут двигаться к медной и
от цинковой пластины начнут двигаться к медной и 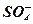 от медной пластины к цинковой. Ток внутри электролита от
от медной пластины к цинковой. Ток внутри электролита от 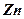 к
к 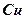 .
.
Аккумулятор – химический источник тока, который способен накапливать в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь.
Накапливание при пропускании по нему тока от постоянного источника – зарядка аккумулятора, где электрическая энергия переходит в химическую энергию, при разряде аккумулятора происходит обратное превращение химической энергии в электрическую.
Аккумуляторы бывают кислотные и щелочные.
Кислотные аккумуляторы. Электроды – свинцовые пластины, покрытые активной массой «+» перекись свинца PbO2, а «-» электрод состоит из губчатого свинца. Электролит 25-34% водный раствор Н2SO4.
Часть окислов Pb переходит в перекись свинца PbO2.
Каждая положительная пластина из Pb в эбонитовом панцире – коричневый цвет. Отрицательная пластина имеет остов в виде решетки из сплава свинца с сурьмой. Образующиеся ячейки заполняют пастой из порошка PbO2 (и сажа, пемза и т.д.) после формовки перекись свинца переходит в чистый свинец Pb, имеющий пористую структуру – поэтому называется губчатый свинец, который имеет серый цвет серый цвет.
При разряде аккумулятора 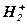 и
и 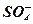 образующиеся при распаде Н2SO4 → направляются соответственно к «+» и «-» электродам и вступают в электрохимическую реакцию с их активными массами. При этом химическая энергия превращается в электрическую энергию и возникает 2В.
образующиеся при распаде Н2SO4 → направляются соответственно к «+» и «-» электродам и вступают в электрохимическую реакцию с их активными массами. При этом химическая энергия превращается в электрическую энергию и возникает 2В.
В результате электрохимической реакции 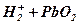 – положительный электрод и ионов
– положительный электрод и ионов 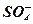 с
с 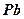 – отрицательный электрод образуется сернокислый свинец
– отрицательный электрод образуется сернокислый свинец 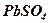 (сульфат свинца) соль белого цвета (при 35% - распад прекращается), которая оседает на поверхности электрода и остается вода
(сульфат свинца) соль белого цвета (при 35% - распад прекращается), которая оседает на поверхности электрода и остается вода 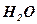 .
.
Саморазряд в неработающем аккумуляторе – теряют свою емкость (примерно 1 – 1,2% в сутки).
Заряд аккумулятора. 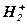 перемещаются к отрицательному электроду, а
перемещаются к отрицательному электроду, а 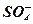 – к положительному электроду и вступают в химическое взаимодействие с сульфатом свинца
– к положительному электроду и вступают в химическое взаимодействие с сульфатом свинца 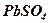 покрывающим оба электрода. Поэтому
покрывающим оба электрода. Поэтому 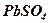 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb отрицательном.
растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb отрицательном.
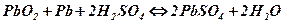
Емкостью аккумулятора называется количество электричества в ампер-часах, которое может дать полностью заряженный аккумулятор при разряде его до предельно допустимого напряжения 1,8 В.
Пример: Емкость аккумулятора 80 А·ч и распадный ток 16А, то аккумулятор можно размещать таким образом в течение 80:16=5 ч.
Емкость определяется размерами аккумулятора.
КПД – отношение количества энергии в кВт·ч, полученной от него при разряде, к количеству энергии, затраченной при заряде.
Кислотные КПД 65 – 75%.
-40 – 50°С – U и емкость падают до 0.
+40 – 90°С – усиливается саморазряд и сокращается срок их службы.
Полностью заряженный аккумулятор 2,2В при разрядке быстро 2В и медленно до 1,8В.
При заряде быстро до 2,2В медленно до 2,3В и быстро до 2,6-2,7, когда аккумулятор как бы «кипит» то полностью заряжен.
Щелочные ЭДС=1,45В до 1,3В.
Электролит 20% едкий калий KOH с примесью едкого лития LiOH.
«+» - электрод, гидрат оксида никеля 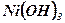
«-» - электрод из Fe или кадмия
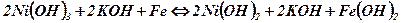
КПД 55 – 65%
Дата добавления: 2017-11-21; просмотров: 1429;











