ЧТО ТАКОЕ ХРОМАТОГРАФИЯ
Хроматография – важнейший аналитический метод. Хроматографическими методами можно определять газообразные, жидкие, и твердые вещества с молекулярной массой от единиц до 106. Это могут быть неорганические вещества, например, ионы металлов, изотопы водорода, и органические – белки, синтетические полимеры и т.д. С помощью хроматографии получена обширная информация о строении и свойствах органических соединений многих классов. Хроматографию с успехом применяют в исследовательских и клинических целях в различных областях биохимии и медицины, в фармацевтике, криминалистике, пищевой промышленности, для мониторинга окружающей среды. Универсальность, экспрессность, чувствительность метода обуславливают частое использование хроматографии в аналитических целях.
Возникновение хроматографии как научного метода связано с именем русского ученого-ботаника М.С.Цвета, который впервые применил явление адсорбции для анализа зеленой части хлорофилловых пигментов листьев. В 1903 г. М.С.Цвет опубликовал статью, в которой сформулировал принцип нового метода и наглядно показал возможность отделения зеленой части хлорофилловых пигментов от желтой и оранжевой с помощью углекислого кальция (адсорбента). Однако метод хроматографии не использовался вплоть до 1930 года, когда немецкие биохимики Кун, Ледерер, Винтерштейн повторили опыты Цвета и успешно разделили каротин на отдельные изомеры, предсказанные Цветом. С этого времени хроматография стала развиваться в самых разнообразных направлениях.
Первые публикации, посвященные применению метода Цвета в неорганическом анализе, относятся к 1937 году и принадлежат Швабу и его сотрудникам. В этих работах приведена методика качественного анализа смесей некоторых катионов и анионов на стеклянной колонке с оксидом алюминия. С 1938 г. широкое распространение получил метод тонкослойной хроматографии, разработанный Н.А.Измайловым и М.C.Шрайбер.
Значительные успехи в разделении и анализе неорганических веществ были достигнуты в 50-х годах, когда в практику хроматографии были введены в качестве адсорбентов ионообменные смолы, что способствовало развитию ионообменной хроматографии. В 1941 году английские ученые Мартин и Синдж предложили метод распределительной хроматографии в жидкостно-жидкостном варианте.
В 1948 г. русские ученые Е.H. Гапон и Т.Б. Гапон предложили осадочную хроматографию, основанную на различной растворимости осадков в подвижной фазе. Первая работа по газовой хроматографии в России была выполнена Н.М. Туркельтаубом в 1949г. В 1952 году Джеймс и Мартин применили газожидкостную хроматографию к анализу жирных кислот. Дальнейшему развитию газовой хроматографии способствовали работы русских ученых А.A. Жуховицкого, М.C. Вигдергауза, A.B. Киселева, Д.A. Вяхирева, А.В. Березкина и других. Более 10 работ (1957–1980), выполненных с применением хроматографических методов, были удостоены Нобелевских премий.
1. Сущность хроматографии
Хроматография – это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Неподвижной фазой обычно служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу.
Компоненты анализируемой смеси вместе с подвижной фазой перемещаются вдоль стационарной фазы, которую обычно помещают в колонку (стеклянную или металлическую трубку). Если молекулы разных компонентов разделяемой смеси обладают различной адсорбируемостью или растворимостью, то время их пребывания в неподвижной фазе, а следовательно, и средняя скорость передвижения по колонке различны. Одни компоненты остаются в верхнем слое сорбента, другие, с меньшей адсорбируемостью, оказываются в нижней части колонки, некоторые покидают колонку вместе с подвижной фазой. Так достигается разделение компонентов. Хроматография – динамический метод, связанный с многократным повторением сорбционных и десорбционных процессов, так как разделение происходит в потоке подвижной фазы. Это обеспечивает эффективность хроматографического метода по сравнению с методами сорбции в статических условиях.
С помощью хроматографии возможны: разделение сложных смесей органических и неорганических веществ на отдельные компоненты, очистка веществ от примесей, концентрирование веществ из сильно разбавленных растворов, качественный и количественный анализ исследуемых веществ.
2. Классификация хроматографических методов
В основу классификации многочисленных хроматографических методов положены следующие признаки:
1) агрегатное состояние фаз;
2) механизм взаимодействия сорбент – сорбат;
3) способы проведения хроматографического анализа;
4) аппаратурное оформление (техника выполнения) процесса хроматографирования;
5) цель хроматографирования.
По агрегатному состоянию фазхроматографию разделяют на газовую и жидкостную. Газовая хроматография включает газожидкостную и газотвердофазную, жидкостная – жидкостно-жидкостную и жидкостно-твердофазную. Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе – неподвижной.
По механизму взаимодействия сорбента и сорбата можно выделить несколько видов хроматографии: адсорбционная основана на различии в адсорбируемости веществ твердым сорбентом; распределительная основана на различной растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различной растворимости веществ в подвижной и неподвижной фазах (жидкостная хроматография); ионообменная хроматография – на разной способности веществ к ионному обмену; эксклюзионная хроматография – на различии в размерах и формах молекул разделяемых веществ; аффинная хроматография – на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов (например, антитело и антиген, гормон и рецептор и др.). Существует осадочная хроматография, основанная на образовании отличающихся по растворимости осадков разделяемых веществ с сорбентом, адсорбционно-комплексообразовательная, основанная на образовании координационных соединений разной устойчивости в фазе или на поверхности сорбента, и др. Следует помнить, что классификация по механизму взаимодействия весьма условна: ее используют в том случае, если известен доминирующий механизм; часто процесс разделения протекает сразу по нескольким механизмам.
По технике выполнениявыделяют колоночную хроматографию, когда разделение проводится в специальных колонках, и плоскостную хроматографию, когда разделение проводится на специальной бумаге (бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография). В колоночной хроматографии используют насадочные или капиллярные колонки. Насадочную колонку заполняют сорбентом (насадкой), а внутреннюю стенку капиллярной колонки покрывают пленкой жидкости или пылью адсорбента.
В зависимости от цели проведенияхроматографического процесса различают аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию часто используют для исследовательских целей при изучении растворов, каталитических процессов, кинетики химических процессов и т.п.
Классификацияпо способам проведения анализаподразделяет хроматографию на три вида: 1) фронтальный, 2) проявительный, 3) вытеснительный .
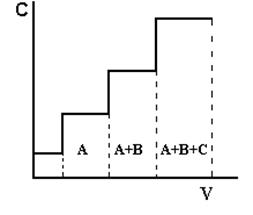
Фронтальный методнаиболее прост по выполнению. Через хроматографическую колонку с сорбентом непрерывным потоком пропускают раствор или газовую смесь исследуемых веществ, сорбируемость которых увеличивается в ряду А < В < С. Соответственно этому компоненты располагаются в колонке. Однако они разделяются не полностью. В чистом виде может быть выделен лишь первый, наиболее слабо сорбирующийся компонент, который движется вдоль слоя сорбента впереди остальных. За зоной первого компонента следует в непосредственном контакте зона, содержащая первый и второй компоненты. Третья зона содержит смесь первого, второго и третьего компонентов. В некоторый момент времени сорбент насыщается, и наступает «проскок», т.е. из колонки начинают выходить компоненты в соответствии с их сорбируемостью. Если пропускать жидкость или газ, выходящие из колонки, через детектор концентраций и наносить показания его в течение всего опыта на график, то полученная выходная кривая будет иметь форму ступенчатой кривой (рис.1.1).
Фронтальный метод не нашел широкого применения в анализе, т.к. не дает полного разделения компонентов анализируемой смеси. Однако этот метод весьма эффективен для препаративного выделения чистого вещества из технического образца при условии, что это вещество удерживается в колонке слабее всех других компонентов объекта анализа.
Типичные примеры применения фронтального анализа: очистка и умягчение воды ионообменными материалами; очистка воздуха активированными углями от отравляющих веществ в противогазах и вентиляционных фильтрах химических предприятий; концентрирование ценных веществ из сточных промышленных вод металлургических предприятий; очистка лекарственных препаратов и пищевых продуктов с помощью ионообменников и т.д.
|
Рис.1.1. Выходная кривая фронтального анализа
А, В, С – разделяемые вещества
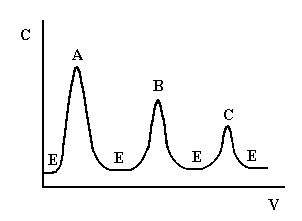
Проявительный (элюентный) метод выгодно отличается от фронтального тем, что он позволяет полностью разделить много-компонентную смесь. Хроматографическую колонку промывают растворителем или газом-носителем (элюентом), обладающим меньшей сорбируемостью, чем любое из разделяемых веществ. Затем в колонку вводят исследуемую смесь в виде порции раствора или газа, а не непрерывно, и продолжают пропускать элюент. При этом разделяемые вещества перемещаются вдоль колонки с разными скоростями в соответствии с их сорбируемостью. На выходе из колонки детектор фиксирует непрерывно концентрацию компонентов, а связанный с ним регистрирующий прибор записывает выходную кривую в виде ряда пиков, число которых соответствует числу разделенных компонентов (рис.1.2).
Проявительный метод анализа получил широкое применение как в жидкостной, так и в газовой хроматографии. Это объясняется тем, что при правильном выборе условий разделения компоненты смеси выходят из колонки в чистом виде, и их можно выделить для исследования другими методами анализа. Кроме того, качественный и количественный состав анализируемой смеси можно определить простым измерением объемов удерживания и площадей пиков соответствующих компонентов на полученной хроматограмме.
Вытеснительный метод отличается от фронтального и проявительного тем, что после введения пробы исследуемой смеси колонку
|
Рис. 1.2. Выходная кривая проявительного анализа
А, В, С – разделяемые вещества, Е – растворитель (элюент)
промывают растворителем или газом-носителем, к которым добавляют раствор вещества (вытеснитель), обладающего большей сорбируемостью, чем любое из разделяемых веществ. По мере продвижения по колонке элюент вытесняет вещество С, которое в свою очередь вытесняет вещество В и т.д. В результате вытесняемая смесь перемещается впереди фронта вытеснителя и скорость движения вещества равна скорости движения вытеснителя. Разделяемые вещества и на колонке, и в элюате располагаются последовательно друг за другом. Каждый из компонентов выделяется в чистом виде, но не количественно, так как зоны компонентов не разделены промежутками чистого сорбента.
Невозможность получения на выходе из колонки достаточно чистых компонентов разделяемой смеси, а также длительность процесса разделения затрудняют использование этого метода в аналитических целях. Однако для препаративных целей метод не потерял значения, так как возможность применения таких высокоактивных и доступных адсорбентов, как активированные угли, позволяет достигнуть высокой производительности. Достоинством метода является также то, что зоны не размываются в отличие от проявительного анализа.
Вопросы для самоконтроля
1. В чем сущность хроматографического процесса?
2. Каково назначение подвижной и неподвижной фаз?
3. Какие процессы происходят в колонке?
4. Как классифицируют методы хроматографии по агрегатному состоянию фаз и по способу хроматографирования??
5. В чем состоит проявительный (элюентный ) анализ?
6. В чем преимущество элюентной хроматографии перед фронтальной и вытеснительной?
7. Как классифицируют методы хроматографии по технике проведения эксперимента и цели ?
8. В чем сущность хроматографического разделения по методу: а) газожидкостной хроматографии; б) распределительной жидкостной хроматографии; в) осадочной хроматографии; г) тонкослойной хроматографии; д) ионообменной хроматографии; е) эксклюзионной хроматографии?
9. Как влияет температура на хроматографический процесс?
3. Ионообменная хроматография
В основе ионообменной хроматографии лежит обратимый стехиометрический обмен ионов, содержащихся в хроматографируемом растворе, на ионы веществ, называемых ионитами или ионобменниками. Иониты могут быть органические и неорганические, природные и синтетические. По знаку обменивающихся ионов различают катиониты (для обмена катионов) и аниониты (для обмена анионов).
К природным ионитам относятся алюмосиликаты, некоторые сорта каменных углей, мягкие и твердые угли даже без предварительной обработки.
В аналитической практике широко используют синтетические иониты. Ионообменники получают реакциями поликонденсации либо полимеризации, линейные цепи полимеров разветвлены и связаны друг с другом «мостиками», например, молекулами дивинилбензола; в состав ионитов входят различные функциональные (ионогенные) группы, которые и определяют наиболее характерные свойства ионитов. Иониты нерастворимы в воде, кислотах, щелочах и во многих органических растворителях, но способны набухать в воде за счет гидрофильных ионогенных групп.
Органические катиониты содержат кислотные функциональные группы: – SO3–, – PO3–, – COO–, – OH –. Органические аниониты содержат группы основного характера: – NH2+,= NH+,  N+, – N(CH3)3+. Катиониты представляют собой полиэлектролиты, диссоциирующие с образованием высокомолекулярного аниона (например, RSO3–) и подвижного катиона (например, Н+- иона),легко обменивающегося на другие катионы. Аниониты диссоциируют на высокомолекулярный катион (например, RNH+) и подвижный анион (например, ОН–), способный обмениваться на другие анионы (R – высокомолекулярный углеводородный радикал ионообменной смолы).
N+, – N(CH3)3+. Катиониты представляют собой полиэлектролиты, диссоциирующие с образованием высокомолекулярного аниона (например, RSO3–) и подвижного катиона (например, Н+- иона),легко обменивающегося на другие катионы. Аниониты диссоциируют на высокомолекулярный катион (например, RNH+) и подвижный анион (например, ОН–), способный обмениваться на другие анионы (R – высокомолекулярный углеводородный радикал ионообменной смолы).
Реакции ионного обмена можно представить схематично сле-дующим образом:
(катионный обмен)
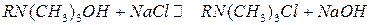
(анионный обмен)
Реакции ионного обмена обратимы и в первом приближении подчиняются закону действующих масс.
Важной характеристикой ионита является его обменная емкость.
3.1. Обменная емкость ионитов
Обменная емкость (ОЕ) – количественная мера способности ионита поглощать противоионы. Численно обменную емкость выражают количеством поглощенных миллимоль эквивалентов ионов на 1г сухой смолы в Н+-форме для катионита и Сl --форме для анионита.
Определение емкости можно отнести и к единице объема набухшего слоя ионита. Обменная емкость, полученная в статических условиях, когда навеску ионита помещают в раствор насыщающего иона определенной концентрации и выдерживают при встряхивании до полного насыщения ионита, называется статической (СОЕ). Величина ее отличается от величины обменной емкости, полученной в динамических условиях при пропускании насыщающего раствора через колонку с ионитом.
|

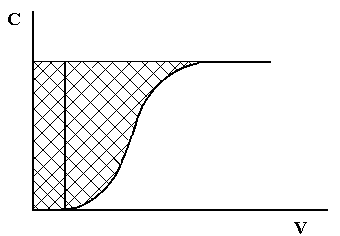
Рис.1.3. Выходная хроматографическая кривая
Динамическая обменная емкость характеризуется двумя показателями: динамической обменной емкостью до проскока (ДОЕ) и полной динамической емкостью (ПДОЕ). ДОЕ представляет собой емкость ионита, определяемую по появлению данного иона в вытекающем из колонки растворе. ПДОЕ определяется по полному прекращению извлечения данного иона из раствора. Это различие можно пояснить графически на рисунке 1.3.
ДОЕ определяется площадью прямоугольника, основанием которого является объем раствора, вытекающего из колонки до наступления проскока иона, а высотой – исходная концентрация обменивающегося иона. ПДОЕ выражается площадью над выходной хроматографической кривой.
ДОЕ всегда меньше, чем полная динамическая обменная емкость, и зависит от ряда факторов: от типа ионита, состава раствора, размера зерен ионита и скорости протекания раствора.
3.2. Классификация ионитов
От вида функциональных групп, входящих в состав ионита, зависит, насколько сильно выражены кислотные или основные его свойства. В зависимости от этого различают четыре группы ионитов.
1. Сильнокислотные катиониты имеют в качестве функциональных групп сульфогруппу –SO3-и фосфорную группу –РО3-. Они используются в кислых, нейтральных и щелочных средах. Это сульфокислотные катиониты полистирольного типа марок КУ-2, КУ-23, СДВ, СБС. К фосфорнокислым относятся катиониты марок КФ-2, КФ-11.Катиониты полистирольного типа выпускаются в виде сферических гранул и имеют либо янтарную, либо светло-желтую окраску.
Катиониты фенольного типа, например, КУ-1, окрашены в черный цвет, их частицы имеют неправильную форму. Такие катиониты бифункциональны, т.е. наряду с группой –SO3-имеют в своем составе группу –ОН-.Преимущество полистирольных катионитов – их монофункциональность, высокая обменная емкость, высокая термическая устойчивость.
2. Слабокислотныекатиониты имеют в качестве функцио-нальных групп карбоксильные группы – СОО-, – ОН-. Это катиониты марок КБ-1, КБ-4, КФУ-1. Катиониты с карбоксильными группами окрашены в белый или светло-зеленый цвет. Важным свойством подобных катионитов является их высокое сродство к иону водорода. Даже небольшого количества разбавленной соляной кислоты достаточно для полной регенерации катионита. Слабокислотные катиониты работают в щелочных и нейтральных средах.
3. Сильноосновные(высокоосновные) аниониты имеют в качестве функциональных групп четвертичные аммониевые группы. Это аниониты марок АВ-16, АВ-17, АВ-18, АВ-20. Они могут применяться для хроматографирования в кислых, щелочных и нейтральных средах. Сильноосновные аниониты имеют желтую или светло-желтую окраску. Они часто используются для разделения большинства ионов металлов. Ион щелочных, щелочноземельных, редкоземельных элементов, алюминия, никеля, меди и др. не сорбируются анионитами при любой концентрации соляной кислоты. Остальные ионы металлов в пределах концентрации НСl от 0,1 до 12 моль/л сорбируются анионитами в различной степени, т.к. образуют анионные хлоркомплексы, имеющие сильно отличающиеся константы нестойкости.
4. Слабоосновные(низкоосновные) аниониты в качестве функциональных групп имеют аминогруппы разной степени замещения:
– NH2+,= NH+, 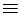 N+. Это аниониты марок АН-2Ф,АН-1, АН-23 и др.Они работают в кислых и нейтральных средах. Анионит ЭДЭ-10П содержит несколько активных аминогрупп вторичного, третичного и четвертичного аммониевых оснований. Поэтому он обладает и слабоосновными, и в некоторой степени сильноосновными свойствами.
N+. Это аниониты марок АН-2Ф,АН-1, АН-23 и др.Они работают в кислых и нейтральных средах. Анионит ЭДЭ-10П содержит несколько активных аминогрупп вторичного, третичного и четвертичного аммониевых оснований. Поэтому он обладает и слабоосновными, и в некоторой степени сильноосновными свойствами.
3.3. Практическое применение ионообменной хроматографии
Методы ионообменной хроматографии используют преимущественно для разделения ионов. Простейшая методика разделения заключается в поглощении смеси компонентов и последовательном элюировании каждого компонента подходящим растворителем. Иониты используют также в водоподготовке (умягчение воды, опреснение морской воды); в гидрометаллургии и гальванотехнике (селективное извлечение ценных металлов из производственных растворов и сточных вод; в пищевой и гидролизной промышленности (очистка сахаросодержащих растворов, осветление плодово-ягодных соков и т.д.); в медицине и фармацевтической промышленности (очистка лекарственных препаратов, антибиотиков).
Рассмотренные области применения ионообменных смол не исчерпывают всего многообразия, однако они показывают широкие возможности, которые открывают использование ионитов в аналитической химии и технологии.
Вопросы для самоконтроля
1. В чем сущность метода ионообменной хроматографии?
2. Как подготовить ионообменную смолу к работе?
3. Какие функциональные группы обеспечивают обменные свойства различных синтетических ионообменных смол? Какие типы катионитов и анионитов Вам известны?
4. Что такое «обменная емкость» ионита, в каких единицах измеряется?
5. Как определяют: а) статическую обменную емкость ионита; б) динамическую обменную емкость ионита?
6. Зависит ли селективность ионообменника от его емкости?
7. Как провести деионизацию воды с помощью ионообменников? Напишите уравнения реакций.
8. Каковы области применения, достоинства и недостатки ионообменной хроматографии?
4. Плоскостная хроматография
К плоскостным видам хроматографии относят бумажную (БХ) и тонкослойную (ТСХ). Эти два вида жидкостной хроматографии просты по технике выполнения, экспрессны, не требуют дорогостоящего оборудования. Разделение этими методами может быть выполнено с использованием хроматографических систем жидкость–твердый сорбент и жидкость–жидкость–твердый сорбент, поэтому выделяют адсорбционную, распределительную, обращенно-фазовую и ионообменную плоскостную хроматографию. Тонкослойную хроматографию используют чаще, чем бумажную.
4.1. Тонкослойная хроматография
Метод тонкослойной хроматографии был разработан Н. А. Измайловым и М. С. Шрайбер еще в 1938 г. В методе ТСХ неподвижная твердая фаза (силикагель, оксид алюминия, порошок целлюлозы) тонким слоем наносится на стеклянную, пластмассовую или металлическую пластинку. В качестве подвижной фазы используют различные растворители или их смеси, органические и неорганические кислоты. Выбор растворителя зависит от природы сорбента и свойств анализируемых соединений. Например, при хроматографировании аминокислот используют смесь n-бутанола с уксусной кислотой и водой, при анализе неорганических ионов – водные буферные растворы, создающие постоянное значение рН. В ТСХ чаще используют восходящий способ получения хроматограммы. Раствор образца наносят микропипеткой на небольшом расстоянии от края пластинки на стартовую линию, и край пластинки погружают в растворитель, который действует как подвижная фаза жидкостной адсорбционной хроматографии. Под действием капиллярных сил растворитель поднимается вверх по пластинке и с разной скоростью переносит за собой компоненты смеси, что приводит к их пространственному разделению. Чтобы растворитель не испарялся с поверхности сорбента, пластинка на время разделения должна быть помещена в герметически закрытую прозрачную камеру. Разделяемые компоненты на пластинке образуют отдельные зоны (пятна). Хроматографирование продолжают до тех пор, пока растворитель не пройдет от линии старта около 10 см до так называемой линии фронта. После этого пластинку вынимают из хроматографической камеры, подсушивают на воздухе и определяют положение пятен.
В нисходящей хроматографии растворитель передвигается по слою вниз под действием и капиллярных, и гравитационных сил. Горизонтальная хроматография выполняется в виде круговой и со свободным испарением растворителя. В круговой хроматографии в центр горизонтально установленной пластинки вносят каплю анализируемой смеси и непрерывно подают растворитель, который под действием капиллярных сил движется в радиальном направлении от центра. Компоненты смеси располагаются в слое в виде концентрических колец.
Схема разделения смеси веществ методом тонкослойной хроматографии приведена на рис.1.4. Пятна характеризуют положение компонентов А, В, С на пластинке в конце опыта.

Рис.1.4. Схема разделения методом восходящей тонкослойной хроматографии
Сорбционные свойства системы в ТСХ характеризуются под-вижностью Rf – относительной скоростью перемещения компонентов в тонком слое. Величины Rf рассчитываются из экспериментальных данных (рис.1.4.):
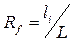 (1.1),
(1.1),
где li – расстояние от стартовой линии до центра пятна, L – расстояние, пройденное растворителем от стартовой линии до границы фронта растворителя.
Rf характеризует положение пятна на хроматограмме. Это константа для данного вещества на данном сорбенте в данной системе растворителей. На величину Rf влияют качество и активность сорбента, его влажность, толщина слоя, качество и природа растворителя, техника эксперимента (способ нанесения пробы, способ детектирования) и другие факторы. На практике часто пользуются относительной величиной
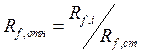 (1.2)
(1.2)
Где Rf,ст также рассчитывают по уравнению (1.1).
Разделение двух веществ с Rf,1и Rf,2 практически возможно, если Rf,1> Rf,2 и Δ Rf ≥ 0,1. Эффективность выбранного варианта ТСХ (адсорбционного, распределительного, ионообменного) и хроматографической системы можно оценить по фактору разделения (селективности) двух веществ с разными коэффициентами распределения:
 (1.3)
(1.3)
Качественный анализ. Проще всего идентификация вещества может быть сделана, если пятно определяемого вещества имеет характерную окраску. Невидимые хроматограммы проявляют соответствующими реагентами, как правило, групповыми. По характерной окраске образующихся цветных зон судят о составе анализируемой пробы. При обработке пластинки, например, парами иода четко проявляются непредельные соединения; при опрыскивании пластинки тиоцианатом кобальта амины образуют голубые пятна на розово-белом фоне. В физических методах проявления используется способность некоторых веществ флуоресцировать под действием УФ-излучения.
Наиболее общий подход к качественному анализу основан на значениях Rf . При соблюдении стандартных условий получаются воспроизводимые значения Rf, которые можно использовать в аналитических целях при сравнении с табличными, если они получены в тех же условиях опыта; более надежно использовать значения Rf,отн.
Самым надежным способом является метод свидетелей (стандартных веществ). Стандартное вещество в том же растворителе наносится на стартовую линию рядом с анализируемой пробой и, таким образом, хроматографируется в тех же условиях (рис.1.4).
Таблица 1.1
Подвижные фазы, проявители, величины Rf некоторых катионов при разделении на микрокристаллической целлюлозе методом ТСХ
| Катион | Подвижная фаза, % | Проявитель | Rf |
| Hg(I) | н-бутанол–вода (85:15); рН 3,0 (СН3СООН) | Водный раствор К2CrO4 | 0,13 |
| Ag(I) | 0,11 | ||
| Pb(II) | 0,05 | ||
| Zn(II) | Этанол–5 М HCl(90:10) | Дитизон | 0,93 |
| Fe(III) | Самоидентификация | 0,80 | |
| Co(II) | 1-Нитрозо-2-нафтол | 0,33 | |
| Ni(II) | Диметилглиоксим | 0,33 | |
| Ca(II) | Изопропанол–вода– 1 М HCl (40:20:20) | Ализарин | 0,73 |
| Sr(II) | Родизонат калия | 0,66 | |
| Ba(II) | Родизонат калия | 0,55 |
По окончании хроматографирования и проявления хроматограммы приступают к идентификации веществ. Совпадение Rfкомпонента пробы и одного из свидетелей дает основание для отождествления веществ.
Количественныеопределения в ТСХ могут быть сделаны непосредственно на пластинке, в этом случае каким-либо способом измеряют площадь пятна и по заранее построенному градуировочному графику находят количество вещества. Применяется также прямое спектрофотометрирование пластинки по спектрам отражения и по спектрам поглощения (фотоденситометрия), для количественных расчетов предварительно строят градуировочный график, используя оптическую плотность в центре пятна Наиболее точным считается метод, когда анализируемое вещество удаляют с пластинки механическим путем или вымывают подходящим растворителем после вырезания зоны, а затем анализируют спектрофотометрическим, флуориметрическим, атомно-абсорбционным методами.
Метод ТСХ прост по методике выполнения и аппаратуре, экспрессен и не требует для анализа больших количеств вещества. Метод широко используется для идентификации компонентов лекарств, биохимических препаратов, неорганических веществ.
4.2. Бумажная хроматография
Вместо пластинок с нанесенным тонким слоем сорбента можно использовать специальную хроматографическую бумагу в виде листов или полосок. Хроматографическая бумага должна быть химически чистой, нейтральной, инертной по отношению к компонентам раствора и подвижной фазе и быть однородной по плотности; имеют значение структура молекул целлюлозы в бумаге, ориентация волокон и другие свойства, влияющие на скорость движения подвижной фазы. Основные операции в бумажной хроматографии проводятся примерно так же, как и в тонкослойной.
Для разделения водорастворимых веществ, например, неорганических ионов, в качестве подвижной фазы обычно берут органический растворитель, а в качестве неподвижной – воду (бумагу заранее смачивают водой). Для разделения компонентов, хорошо растворимых в органических растворителях, гидрофильную бумагу превращают в гидрофобную, пропитывая ее растворами органических веществ (парафина, растительного масла и др.), а в качестве подвижной фазы используют воду, водный раствор какой-либо кислоты или щелочи, буферный раствор.
Растворители подвижной и неподвижной фаз не должны смешиваться, состав растворителя в процессе хроматографирования не должен изменяться, растворители должны легко удаляться с бумаги. Индивидуальные растворители используются достаточно редко. Чаще для этой цели применяют смеси веществ, например, бутилового или амилового спирта с метиловым или этиловым, смеси бутилового спирта с уксусной кислотой, аммиаком и др.
По технике выполнения различают следующие виды бумажной хроматографии: одномерную, двумерную, круговую и электрофоретическую. Для получения двумерных хроматограмм хроматографирование проводят дважды: после обработки пробы одним растворителем хроматограмму поворачивают на 90° и хроматографируют вторично уже другим растворителем. Такая методика позволяет проводить более тонкие разделения компонентов смеси. Специфическим приемом является сочетание БХ и электрофореза. Для этого к влажному листу хроматографической бумаги прикладывают постоянное электрическое напряжение. Дополнительное воздействие электрического поля приводит к более четкому разделению, особенно для ионов с разными зарядами. Электрофорез можно проводить одновременно с хроматографированием, а также до или после хроматографирования.
Качественный состав пробы в методе бумажной распределительной хроматографии так же, как и в ТСХ, может быть установлен или по специфической окраске отдельных пятен на хроматограмме, или по численному значению Rfкаждого компонента. Количественные определения в БХ выполняются по хроматографическим характеристикам (по площади пятна на хроматограмме и интенсивности его окраски) или после вымывания подходящим физико-химическим методом. Отметим, что метод бумажной хроматографии, предложенный в 1941 г. Мартином и Синджем, в настоящее время используют в аналитических лабораториях довольно редко.
Вопросы для самоконтроля
1. Каковы преимущества двумерной хроматографии перед одномерной бумажной или ТСХ?
2. Как идентифицировать пятна органических соединений в методе ТСХ?
3. Как выполняют количественный анализ в методе ТСХ?
4. Как определяют Rf в методе БХ и ТСХ? От чего зависит величина Rf и какие условия нужно поддерживать постоянными при проведении эксперимента?
5. Как можно определить концентрации компонентов смеси после разделения методом БХ или ТСХ?
6. Как выполняется качественный анализ с помощью плоскостных вариантов хроматографии – БХ и ТСХ?
7. Какими способами проба анализируемой смеси веществ вводится в хроматографическую установку в бумажной хроматографии?
8. Почему в методе ТСХ необходимо герметически закрывать камеру с растворителем и пластинкой во время подъема фронта растворителя?
9. Как обнаруживают и идентифицируют компоненты на бумажных и тонкослойных хроматограммах?
10. Каковы области применения, достоинства и недостатки тонкослойной хроматографии?
5. Газовая хроматография
Газовая хроматография – это вариант хроматографии, в котором подвижной фазой является инертный газ (газ-носитель), протекающий через неподвижную фазу, обладающую большой поверхностью. Обычно в качестве подвижной фазы используют гелий, азот, аргон, водород, диоксид углерода или воздух. Газ-носитель должен быть инертным по отношению к разделяемым веществам и сорбенту, взрывобезопасным и достаточно чистым. Выбор газа-носителя в каждом конкретном случае должен обеспечивать соответствие его физических свойств получению высокой эффективности колонки и достаточной чувствительности детектора.
В зависимости от агрегатного состояния неподвижной фазы газовая хроматография подразделяется нагазоадсорбционную, когда неподвижной фазой является твердый адсорбент, и газожидкостную, когда неподвижной фазой является жидкость, нанесенная на поверхность твердого носителя. В газовой хроматографии используется преимущественно элюентный (проявительный)способ проведения процесса хроматографирования .
Газовая хроматография – метод разделения летучих соединений. Этим методом можно проанализировать газообразные, жидкие и твердые вещества с молекулярной массой меньше 400, удовлетворяющие определенным требованиям, главные из которых – летучесть, термостабильность, инертность и легкость получения. Количественный анализ можно провести только в том случае, если вещество термостойко, т.е. испаряется в дозаторе воспроизводимо и элюируется из колонки без разложения. При разложении вещества на хроматограмме появляются ложные пики, относящиеся к продуктам разложения. Вещество не должно образовывать устойчивых сольватов при растворении в неподвижной жидкой фазе и реагировать с материалами, из которых изготовлены детали хроматографа. Этим требованиям удовлетворяют, как правило, органические вещества, поэтому ГХ чаще используют как метод анализа органических соединений, хотя этим методом можно определять почти все элементы периодической системы в виде летучих соединений.
5.1. Газотвердофазная хроматорафия
Вгазоадсорбционной хроматографии в качестве неподвижной фазы применяют различные адсорбенты – вы
Дата добавления: 2017-11-21; просмотров: 7946;











