Ядерная модель атома
Рассматриваются опыты Резерфорда,
приведшие к установлению ядерной модели атома.
Излагается элементарная квантовая теория Бора
строения и излучения атома водорода и ее
элементарное обобщение на эллиптические орбиты
с учетом конечной массы ядра.
Две модели строения атома. В начале XX в. реальность атомов стала общепризнанной; установлено существование положительных и отрицательных зарядов и открыт носитель отрицательного заряда - электрон; носитель положительных зарядов (протон) оставался неизвестным, но существование положительных ионов известно. Было ясно, что атомы составляют сложную электрическую систему, имеющую размер порядка 10-8 см. На повестку дня встал вопрос о строении атома. Поскольку в целом атом нейтрален, положительные и отрицательные заряды, входящие в атом, должны взаимно компенсироваться. Теоретически существовали две модели строения атома. Согласно первой модели (модель Томсона), по всему объему атома с некоторой объемной плотностью распределен положительный заряд. Электроны погружены в эту среду из положительного заряда. Электроны взаимодействуют с элементами положительно заряженной среды атома по закону Кулона. При отклонении электрона от положения равновесия возникают силы, которые стремятся возвратить его в положение равновесия. Благодаря этому возни возникают колебания электрона. Колебания электронов обусловливают излучение атомов. Вторая модель приписывала атому строение, аналогичное строению Солнечной системы: в центре находится положительно заряженное ядро, вокруг которого, подобно планетам, движутся электроны, удерживаемые у ядра силами кулоновского притяжения. Каково строение атома в действительности, мог решить только эксперимент. Задача состояла в том, чтобы определить распределение электрического заряда в атоме. Основная идея заключалась в использовании того факта, что законы рассеяния заряженных частиц атомами зависят от распределения заряда в атоме. Зная эту зависимость, можно по рассеянию заряженных частиц на атомах определить распределение заряда в нем, т.е. экспериментально исследовать строение атома.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871 —1937) по рассеянию a-частиц в веществе. Альфа- частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки а-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость порядка 107 м/с). Резерфорд, исследуя прохождение a-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые a-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как a-частицы, то Резерфордом был сделан вывод, что значительное отклонение a-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие a-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z — порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10-15— 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов. Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса г. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
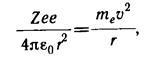 (16.1)
(16.1)
где m и u — масса и скорость электрона на орбите радиуса г, e0 — диэлектрическая постоянная. Уравнение (16.1) содержит два неизвестных: г и u. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины г, u (следовательно, и Е) могут меняться непрерывно, т. е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр. Из выражения (16.1) следует, что при радиусе r~10-10м скорость движения электронов u= 106 м/с, а ускорение u2/r=1022 м/с2. Согласно электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности. Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.
Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 г. датским физиком Нильсом Бором (1885—1962). Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата. Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
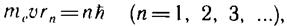 (16.2)
(16.2)
где mе— масса электрона, u— его скорость по n-ой орбите радиуса гn, 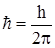 .
.
Второй постулат Бора (правило частот): при переходе электрона с одной
стационарной орбиты на другую излучается (поглощается) один фотон с энергией
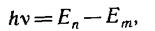 (16.3)
(16.3)
равной разности энергий соответствующих стационарных состояний (Еn и Еm— соответственно энергии стационарных состояний атома до и после излучения (поглощения). При Еm<Еn происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn<Еm — его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот n == (En — Em)/h квантовых переходов и определяет линейчатый спектр атома.
Дата добавления: 2017-10-04; просмотров: 2262;











