Модели атомов. Атомные спектры
Атомные спектры
Излагаются экспериментальные закономерности атомных спектров и анализируется их несовместимость с классическими представлениями об излучении
Возбуждение спектров излучения. Материальные тела являются источниками электромагнитного излучения. В принципе существует два вида излучения, различающихся способом их возбуждения: 1) тепловое излучение; 2) различные виды люминесценции: а) электролюминесценция, б) хемилюминесценция, в) флуоресценция. Тепловое излучение возникает в результате нагревания тел. При столкновении друг с другом атомы и молекулы приобретают энергию, переходя в возбужденное состояние. Затем эту энергию они излучают. Таким образом, источником энергии при тепловом излучении является кинетическая энергия теплового движения атомов и молекул. Люминесценцией называются все виды испускания света, в которых кинетическая тепловая энергия несущественна для механизма возбуждения. Электролюминесценцией называется свечение в электрических разрядах всех видов. Хемилюминесцещией называется излучение, когда возбуждение атомов происходит в результате химических реакций. Флуоресценция -это излучение атомов, возбужденных в результате поглощения света.
Во второй половине 19 столетия были проведены многочисленные и тщательные исследования спектров излучения. Оказалось, что спектр излучения молекул состоит из широких размытых полос без резких границ. Такого рода спектры были названы полосатыми. Спектр излучения атомов имеет совсем другой вид. Он состоит из отдельных, резко обозначенных линий. В связи с этим спектры атомов были названы линейчатыми. Для каждого элемента имеется вполне определенный излучаемый им линейчатый спектр. Вид линейчатого спектра не зависит от способа возбуждения атома. По спектру можно определить элемент, которому он принадлежит. Линии в спектрах располагаются закономерно. Найти закономерности расположения линий излучения в линейчатых спектрах и объяснить эти закономерности было важнейшей задачей физического исследования. Первые шаги были сделаны в направлении подбора эмпирических формул, которые бы правильно описывали положение отдельных линий в спектрах. Первый удачный шаг был сделан Бальмером, нашедшим эмпирическую формулу для части линий излучения в спектре атома водорода.
Экспериментальные спектре атома водорода.
Экспериментальные закономерности в линейчатых спектрах. Анализ эмпирического материала по линейчатым спектрам показал, что отдельные линии в спектрах могут быть объединены в группы линий, которые принято называть сериями. Бальмер открыл (1885), что линии в видимой части спектра водорода можно представить следующей простой формулой:
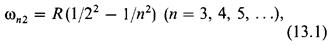
где R-постоянная величина, 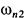 частота излучения соответствующей линии. Эта серия линий называется серией Балъмера. Лайман открыл (1906) другую серию линий, лежащую в ультрафиолетовой части спектра атома водорода: -
частота излучения соответствующей линии. Эта серия линий называется серией Балъмера. Лайман открыл (1906) другую серию линий, лежащую в ультрафиолетовой части спектра атома водорода: -
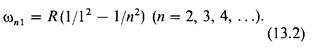
Эта серия называется серией Лаймана. Пашен открыл (1908) серию в ин-
инфракрасной части спектра атома водорода:
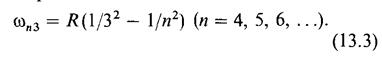
Эта серия называется серией Пашена. В дальнейшем в инфракрасной части спектра водорода были открыты также другие серии: серия Брэкета
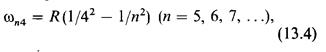
серия Пфундта
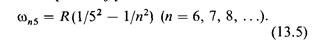
Рассмотрение формул (13.1 — 13.5) для частот спектральных серий показывает, что каждая из частот является разностью двух величин, зависящих от целого числа. Если

то каждую излученную частоту можно представить в виде разности величин (13.6) при различных значениях целых чисел:

Серия линий получается по формуле (13.7), если одно из целых чисел фиксировано, а другое пробегает все целые значения, большие фиксированного целого числа.
Комбинационный принцип. Таким образом, излучение атома водорода
характеризуется величинами
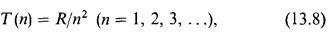
которые называются спектральными термами. Все излучаемые частоты могут
быть представлены как комбинации спектральных термов вида (13.7). Это правило, сформулированное Ритцем (1908), называется комбинационным принципом Ритца. Исследование спектров более сложных атомов показало, что частоты линий их излучения также представляются в виде разностей спектральных термов, характерных для данного атома, но формулы для термов бывают несколько сложнее, чем формула (13.6) для атома водорода.
Дата добавления: 2017-10-04; просмотров: 1672;











