Классификация лекарственных средств, влияющих на плазменно-коагуляционный гемостаз.
I. Антикоагулянты.
A. Прямые антикоагулянты:
1. Непрямые антагонисты тромбина:
· цитрат натрия,
· гепарины – гепарин, эноксапарин, надропарин;
· гепариноиды – сулодексид, данапароид.
2. Прямые антагонисты тромбина:
· пептидные (гирудин и его производные) – десулъфатогирудин, гирулог;
· синтетические гетероциклические дериваты гирудина:
Þ производные аргинина – аргатробан, новастан, иногатран, напсагатран;
Þ производные бензамидина – тромстоп;
Þ производные лизина.
· олигонуклеотиды-аптамеры (дериваты ДКН и РНК, содержащие тромбинсвязывающие домены) – дефибротид.
B. Непрямые антикоагулянты:
1. Производные 4-оксикумарина: варфарин, синкумар, неодикумарин;
2. Производные индандиона: фениндион.
II. Прокоагулянты: витамин К, тромбин, фибриноген, протамина сульфат.
III. Фибринолитические средства.
A. Фибринолитические средства I поколения:
1. Прямые фибринолитики (препараты плазмина): фибринолизин;
2. Непрямые фибринолитики (активаторы плазминогена): стрептокиназа, стрептодеказа, урокиназа.
B. Фибринолитические средства II поколения: анистрептаза, проурокиназа, t-РА.
IV. Ингибиторы фибринолиза: e-аминокапроновая кислота, пара-аминобензойная кислота, транексамовая кислота.
Антикоагулянты.
Контроль эффективности и безопасности терапии антикоагулянтами. Для контроля за эффективностью терапии антикоагулянтами применяют следующие лабораторные тесты:
1. Время свертывания крови по Ли-Уайту - время необходимое для образования сгустка венозной крови. Отражает процесс свертывания крови в целом. В норме составляет от 8 до 12 минут. При терапии антикоагулянтами рекомендуется поддерживать его увеличенным в 2 раза. Данный тест является ориентировочным и может выполняться для экспресс-диагностики эффективности и безопасности терапии.
2. Активированное частичное тромбопластиновое время (АЧТВ, каолин-кефалиновое время). Тест основан на определении времени, необходимого для свертывания рекальцифи-цированной плазмы после добавления к ней отрицательно заряженных фосфолипидов (кефалин) или силиката алюминия (каолин). Этот тест отражает активацию X фактора по внутреннему пути, т.е. позволяет судить об активности всех факторов свертывания крови, за исключением III и VII. В норме его значение составляет 30-40 секунд. При применении антикоагулянтов (гепарина и др.) рекомендуется добиваться увеличения этого показателя в 2 раза.
3. Протромбиновое время (тромбопластиновое время). Время образования сгустка рекаль-цифицированной плазмы при добавлении к ней стандартного тромбопластина. Как правило, в качестве тромбопластина применяют полученный методом высаливания экстракт мозга человека, кролика или быка. Протромбиновое время характеризует активность I, II, V, VII и X факторов и позволяет оценить эффективность терапии непрямыми антикоагулянтами. В норме протромбиновое время составляет 11-15 сек. При антикоагулянтной терапии рекомендуют добиваться его увеличения в 2 раза.
4. Стандартизированные показатели фазы образования тромбина:
· Протромбиновый индекс (ПИ) – показатель, принятый в отечественной гематологической практике и отечественной же литературе. Определяется как соотношение: 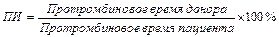 . Этот способ расчета позволяет нивелировать различия, которые имеются в активности тромбопластина, полученного из разных партий. В норме значения этого теста составляют 90-110%. В случае антикоагулянтной терапии его рекомендуется поддерживать на уровне 50-60%.
. Этот способ расчета позволяет нивелировать различия, которые имеются в активности тромбопластина, полученного из разных партий. В норме значения этого теста составляют 90-110%. В случае антикоагулянтной терапии его рекомендуется поддерживать на уровне 50-60%.
· Протромбиновое соотношение (протромбиновый коэффициент) – аналогичный показатель, принятый в зарубежной практике. Определяется как следующее соотношение: 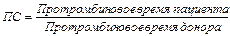 . В норме значения протромбинового соотношения составляют 0,9-1,1. В случае терапии непрямыми антикоагулянтами его рекомендуется доводить до 2,0-3,5.
. В норме значения протромбинового соотношения составляют 0,9-1,1. В случае терапии непрямыми антикоагулянтами его рекомендуется доводить до 2,0-3,5.
· Международное нормализованное соотношение (МНС, INR) – этот показатель позволяет учесть отличия не только в чувствительности тромбопластина из разных партий, но и тромбопластина, полученного от разных источников. Все тромбопла-стины стандартизируют по ISI (International Sensitivity Index – Международному индексу чувствительности). За эталонный тромбопластин с ISI=1,0 принят тромбопластин мозга человека. Значения ISI для тромбопластина плаценты также составляют 1,0, а значения для кроличьего тромбопластина колеблятся от 1,8 до 2,3. Согласно рекомендациям ВОЗ для определения протромбиновых показателей следует использовать тромбопластины с активностью не более 1,4. Значение МНС расчитывают по следующей формуле: 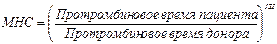 .В норме МНС близко к 1,0 и не превышает 1,4. При лечении непрямыми антикоагулянтами рекомендуют придерживаться следующих показателей МНС:
.В норме МНС близко к 1,0 и не превышает 1,4. При лечении непрямыми антикоагулянтами рекомендуют придерживаться следующих показателей МНС:
| Клинические показания | Показатель МНС | |
| БОГ[1], 1990 | АИСЛК[2] | |
| Профилактика послеоперационных тромбозов глубоких вен Лечение тромбозов вен Инфаркт миокарда (профилактика эмболии) Протез клапана сердца (профилактика эмболии) Мерцательная аритмия (профилактика эмболии) ТЭЛА Рецидивирующая системная эмболия | 2,0-3,0 2,0-3,0 2,0-3,0 3,0-4,5 2,0-3,0 3,0-4,5 3,0-4,5 | 2,0-3,0 2,0-3,0 2,0-3,0 3,0-4,5 2,0-3,0 2,0-3,0 3,0-4,5 |
Для контроля за безопасностью терапии используют следующие тесты:
· Время свертывания крови по Ли-Уайту. При использовании средних доз гепарина (20.000-35.000 ЕД/сут) его определяют не реже 2 раз в день, как правило, перед введением очередной дозы гепарина. При использовании низких доз (10.000-20.000 ЕД/сут) время свертывания определяют не реже 1 раза в 3 дня на высоте действия гепарина.
· Исследование мочи на наличие эритроцитов и кала на скрытую кровь (проба Григерсена). При проведении антикоагулянтной терапии исследование мочи и кала следует проводить не реже 1 раза в 3 дня. Появление эритроцитов в моче или положительной реакции в пробе Григерсена следует расценивать как угрозу развития кровотечения и дозу антикоагулянтов слудует незамедлительно уменьшить, либо полностью отменить эту группу средств.
Прямые антикоагулянты – лекарственные средства, которые оказывают непосредственное влияние на активность циркулирующих в крови факторов свертывания и эффективны как при введении in vivo, так и in vitro.
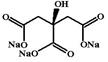 Гидроцитрат натрия (Natrii citras pro injectionibus).Представляет собой тринатриевую соль лимонной кислоты. МД: при внутривенном введении образует кальций-натриевую соль лимонной кислоты, быстро связывая ионизированный кальций. Понижение концентрации ионизированного кальция нарушает процесс образования тромбопластина и тромбина, т.к. в отсутствии кальция не происходит правильная фиксация факторов свертывания крови на фосфолипидных матрицах.
Гидроцитрат натрия (Natrii citras pro injectionibus).Представляет собой тринатриевую соль лимонной кислоты. МД: при внутривенном введении образует кальций-натриевую соль лимонной кислоты, быстро связывая ионизированный кальций. Понижение концентрации ионизированного кальция нарушает процесс образования тромбопластина и тромбина, т.к. в отсутствии кальция не происходит правильная фиксация факторов свертывания крови на фосфолипидных матрицах.
ФЭ. цитрат натрия удлиняет время свертывания крови как in vivo (при внутривенном введении), так и in vitro. При приеме внутрь вызывает изменение рН мочи на сильнощелочное, что иногда используют при симптоматическом лечении цистита. При введении внутрь цитрат натрия не оказывает никакого влияния на свертывание крови, поскольку в процессе абсорбции из кишечника он сразу включается в цикл трикарбоновых кислот и не поступает в свободном виде в кровь.
Показания: В виде 4-5% раствора используют для консервирования крови. При последующем применении такой крови на каждые 500 мл перелитой крови вводят 10 мл 10% раствора хлорида кальция. В противном случае у пациента может развиться «цитратный шок» из-за избыточного количества гидроцитрата натрия, который содержится в консервированной крови. Перорально гидроцитрат натрия применяют у детей при лечении передозировки сердечных гликозидов. Для симптоматического лечения цистита у пожилых лиц также иногда используют пероральное введение гидроцитрата. Смена реакции мочи с кислой на сильнощелочную позволяет быстро устранить симптомы дизурии. Такой метод лечения цистита не применяется у молодых людей, т.к. у них причиной цистита чаще всего бывает инфекционный процесс, тогда как у пожилых лиц он обычно связан с развитием атрофических процессов в слизистой оболочке мочевого пузыря.
РД: при лечении цистита и интоксикации сердечными гликозидами порошок цитрата натрия из пакетика растворяют в 1 литре воды, после чего раствор принимают по ½ стакана 3 раза в день.
НЭ: При введении высоких доз цитрата натрия внутривенно может развиться «цитратный шок». В результате замещения ионов кальция на натрий в мышечной ткани возникает резкая мышечная слабость и несостоятельность сократительной функции скелетных мышц (нарушение дыхания), мышц сосудов (гипотония и нарушение перфузии тканей) и миокарда (аритмии).
ФВ: пакетики с порошком по 20,0.
Гепарин (Heparin)– сульфатированный мукополисахарид, который за счет остатков серной кислоты (-SO3H) имеет избыточный отрицательный заряд.
Историческая справка. В 1916 г. американский студент-медик J. McLean при изучении липидного прокоагулянта неожиданно обнаружил фосфолипидный компонент, который обладал сильным антикоагулянтным эффектом. В 1922 г. Howell, в лаборатории которого в то время как раз работал J. McLean, выделил этот антикоагулянт в водорастворимой форме и назвал его гепарином. В 1939 г. K. Brinkhous и сотр. обнаружили, что противосвертыеающий эффект гепарина опосредован эндогенным компонентом плазмы крови. В 1969 г. этот фактор противосвертывающей системы был идентифицирован как антитромбин III.
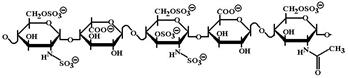 Гепарин состоит из остатков N-ацетилглюкозамина и D-глюкуроновой кислоты (или ее изомера L-идуроновой кислоты). Антикоагулянтный эффект гепарина зависит от количества L-идуроновой кислоты в молекуле: чем ее больше, тем выше активность гепарина. В обычных коммерческих препаратах гепарина до 70% всех кислотных остатков представлены идуроновой кислотой.
Гепарин состоит из остатков N-ацетилглюкозамина и D-глюкуроновой кислоты (или ее изомера L-идуроновой кислоты). Антикоагулянтный эффект гепарина зависит от количества L-идуроновой кислоты в молекуле: чем ее больше, тем выше активность гепарина. В обычных коммерческих препаратах гепарина до 70% всех кислотных остатков представлены идуроновой кислотой.
Гепарин синтезируется в тучных клетках из N-ацетилглюкозамина и D-глюкуроновой кислоты и хранится в специальных гранулах. В каждой грануле содержится 10-15 цепей гепарина из 200-300 субъединиц, присоединенных к белковому ядру, общая масса получившегося гликопептида составляет 750.000-1.000.000 Да. Внутри гранул гепарин подвергается сульфатированию, а D-глюкуроновая кислота изомеризуется в L-идуроновую. Каждая из этих реакций при синтезе гепарина не является обязательной, поэтому, даже в одной клетке молекулы гепарина могут существенно отличаться друг от друга. Перед секрецией гликопептид подвергается ферментативному гидролизу эндо-b-D-глюкуронидазой и гепарин выделяется в виде фрагментов массой 5.000-30.000 Да. В крови гепарин не определяется, т.к. быстро разрушается гепариназами печени и крови.
Для клинического применения гепарин получают из слизистой оболочки кишечника свиней или легких крупного рогатого скота. Препараты коммерческого гепарина имеют молекулярную массу 15.000-30.000 Да. В связи с тем, что они различаются по происхождению, степени очистки и содержанию воды их дозировка выражается не в мг, а в международных единицах (ЕД). Согласно фармакопее США за 1 ЕД принимают такое количество гепарина, которое предотвращает свертывание 1 мл цитратной плазмы овец в течение 1 часа при добавлении к ней 0,2 мл 1% раствора хлорида кальция. Активность 1 мг гепарина составляет 120-130 ЕД.
В целом, препараты свиного гепарина более активные (сильнее ингибируют фактор Ха) и действуют более длительно. Для нейтрализации свиного гепарина требуется меньше про-тамина. Полагают, что эти различия обусловлены меньшим содержанием в свиных гепари-нах хондроитина. Кроме того, было показано, что препараты свиного гепарина реже вызывают тромбоцитопению (в 5,8% случаев, тогда как для бычьих гепаринов этот показатель равен 15,6%).
Существуют различные соли гепарина – натриевая, кальциевая, калиевая, магниевая, бариевая. Наиболее широко в клинической практике применяются нариевая и кальциевая соли. Клиническая эффективность этих солей примерно одинакова, однако, натриевая соль чаще вызывает гематомы и болезненность в месте введения (в 4,5% случаев, против 3,5% при использовании кальциевой соли), но абсорбция кальциевой соли из места введения менее предсказуема по сравнению с натриевыми солями гепарина.
МД: активный центр гепарина представлен пентасахаридом «N-сульфатированный глюкозамин-6-О-сульфат, L-идуроновая кислота, N-сульфатированный глюкозамин-3,6-О-сульфат, D-глюкуроновая кислота, N-ацетилглюкозамин-6-О-сульфат» (на рисунке слева направо), который имеется примерно на 30% молекул коммерческих препаратов гепарина. Гепарин выступает в роли кофактора антитромбина III. Сам по себе антитромбин III обладает собственной антикоагулянтной активностью, но в отсутствие гепарина она чрезвычайно низка. После взаимодействия с гепарином антикоагулянтная активность антитромбина увеличивается в 700-1000 раз. Гепарин подобно своеобразной «матрице» соединяется с антитромбином III и «раскрывает» его активный центр таким образом, что антитромбин III легко образует комплексы с каталитическими центрами II, VII, IX, X и XI факторов свертывающей системы. Сразу после связывания антитромбина с этими факторами свертывания гепарин диссоциирует из комплекса и может активировать следующую молекулу антитромбина III (т.е. в ходе этой реакции гепарин не расходуется, а выступает в роли истинного катализатора).
Связывание антитромбина III с факторами свертывающей системы чрезвычайно прочное и они не могут провести гидролиз антитромбина. В итоге, активные центры факторов свертывающей системы оказываются блокированы и они теряют способность выступать в качестве ферментов и активировать другие факторы каскада коагуляции. Таким образом, антитромбин III является своеобразным «летальным» субстратом для факторов свертывающей системы крови.
Другой, не менее важной стороной действия комплекса «гепарин-антитромбин III» является его способность фиксироваться на рецепторах эндотелиальных клеток и стимулировать поступление в кровь ТFPI, в результате чего его уровень в крови повышается в несколько раз. ТFPI ингибирует комплекс «IIIа-VIIа-Ха-Са2+» и приводит к нарушению не только конечного этапа свертывания крови (активация протромбина), но и его начального этапа по внешнему пути (образование протромбиназы).
В настоящее время показано, что действие гепарина связано не только с его влиянием на активность антитромбина III. Установлено, что гепарин повышает антитромботический потенциал эндотелия. При введении в кровоток он быстро фиксируется на поверхности эн-дотелиальных клеток и увеличивает их отрицательный заряд. Так, уже через 5 минут после внутривенного введения концентрация гепарина на эндотелии в 75-100 раз превышает его концентрацию в плазме крови.
ФЭ: Гепарин оказывает дозозависимое антикоагулянтное действие:
· при концентрации в плазме менее 0,1 ЕД/мл гепарин замедляет скорость активации фактора Ха, не влияя существенно на общее время свертывания крови;
· в концентрации 0,2-0,5 ЕД/мл вызывает гипокоагуляцию, инактивирует фактор Ха (удлиняет АЧТВ) и замедляет активацию фактора II (тромбина);
· в концентрации 0,7-0,8 ЕД/мл гепарин инактивирует факторы Ха и IIа, удлиняя АЧТВ и тромбиновое время;
· в концентрации более 1 ЕД/мл (>100.000 ЕД/сут) гепарин обладает собственным анти-коагулянтным эффектом, не зависящим от наличия в плазме антитромбина III. В настоящее время полагают, что эта «собственная» антикоагулянтная активность гепарина связана с его способностью активировать гепариновый кофактор II – один из представителей серпиновых антикоагулянтов. В отличие от антитромбина III гепариновый кофактор II не только угнетает процесс коагуляции крови, но и несколько увеличивает активность плаз-мина.
Кроме антикоагулянтного эффекта, для гепарина характерен ряд других полезных фармакологических эффектов:
1. Гепарин оказывает антиагрегантное действие, благодаря повышению отрицательного заряда эндотелия при связывании со специфическими рецепторами на его поверхности.
2. В относительно высоких дозах гепарин стимулирует фибринолиз. Отчасти это обусловлено его влиянием на гепариновый кофактор II (см. выше), а также способностью гепарина связывать и инактивировать РАI-1 (ингибитор активатора плазминогена).
3. Гепарин оказывает гиполипидемическое действие – увеличивает скорость гидролиза триглицеридов в составе хиломикронов и ЛПОНП плазмы крови и понижает тем самым уровень холестерина и триглицеридов плазмы. Этот эффект объясняют способностью гепарина стимулировать секрецию липопротеинлипазы в кровь. Следует помнить, что липолитический эффект гепарина конкурирует с его антикоагулянтным эффектом, поэтому у лиц с гиперлипидемией антикоагулянтное действие гепарина может быть незначительным. Кроме того, липолитический эффект гепарина приводит к увеличению содержания жирных кислот в плазме и усилению их транспорта в миокард. Окисление жирных кислот требует значительных расходов кислорода, поэтому у пациентов с миокардитами и кардиомиопатиями перегрузка клеток миокарда жирными кислотами может спровоцировать срыв ритма.
4. Гепарин тормозит пролиферацию гладкомышечных клеток сосудов, замедляет процессы атероматозного повреждения и гипертрофии миокарда и артериол у пациентов с артериальной гипертензией. Полагают, что этот эффект гепарина связан с его способностью образовывать стабильные комплексы с кислым и основным факторами рота фибробластов (aFGF и bFGF). У лиц с артериальной гипертензией и гломерулонефритом эти факторы роста присутствуют в чрезвычайно высоких концентрациях и способны активировать т.н. низкоаффинные рецепторы миоцитов и мезенхимальных клеток, запуская процесс их неконтролируемой пролиферации. Благодаря комплексообразованию с гепарином возникает своеобразное депо ростовых факторов, из которого происходит их медленное выделение, благодаря чему ростовые факторы воздействуют в первую очередь на высокоаффинные рецепторы мезенхимальных, гладкомышечных и эндотелиальных клеток. Активация высокоаффинных рецепторов – необходимое условие реализации антипролиферативного эффекта факторов роста.
5. Гепарин нарушает кооперацию Т- и В-лимфоцитов в ходе иммунного ответа, инактиви-рует систему комплимента, что в итоге проявляется противовоспалительным и иммуно-депрессивным действием.
6. Гепарин потенцирует гипогликемизирующий эффект инсулина и пероральных сахаропо-нижающих средств.
7. Гепарин снижает способность тироксина связываться с тироксинсвязывающим белком плазмы крови. Это приводит к увеличению свободной фракции Т4 в крови и возникновению гипертиреоза у лиц с исходно повышенным уровнем этого гормона.
8. Гепарин тормозит избыточный синтез альдостерона. Снижение уровня альдостерона обеспечивает диуретический эффект гепарина и его К+-сберегающее действие.
ФК: Гепарин хорошо всасывается после перорального введения. Однако, в процессе абсорбции он подвергается действию нитродесульфамидаз, которые вызывают десульфатиро-вание гепарина. Десульфатированный гепарин утрачивает многие из своих свойств: он не способен фиксироваться на эндотелии сосудов, а практически полностью поступает в печень, где гепариназами разрушается до низкомолекулярных фрагментов, которые в виде комплексов выводятся почками. В 80-90-е гг XX века в США, Японии, Германии и Италии были созданы особые пероральные формы гепарина, которые обеспечивали высокую скорость его поступления в кровоток и тем самым защищали от десульфатирования. Однако, эти препараты не нашли широкого клинического применения.
Основными путями введения гепарина в настоящее время являются подкожный и внутривенный. При подкожном введении гепарин вводят в область фланков живота, чуть ниже пупка. Инъекцию выполняют в кожную складку, строго перпендикулярно, т.к. при такой технике исключено случайное введение гепарина в дерму и его разрушение нитродесульфа-мидазами. Биодоступность гепарина после подкожного введения составляет около 30%. Ан-тикоагулянтный эффект достигает максимума уже через 40-60 мин и продолжается до 6-8 часов.
Внутривенно гепарин может вводиться в виде длительной внутривенной инфузии и в виде болюсно-инъекционного режима. После однократного болюсного введения гепарина гипокагуляция возникает немедленно и уже через 10 мин она может доходить до полной несвертываемости крови. Такой резкий сдвиг коагулянтного потенциала таит в себе угрозу развития геморрагий и гематом (например, в виде инсультов) у пациентов с артериальной ги-пертензией, язвенными поражениями ЖКТ. Кроме того, первоначальная гипокоагуляция очень кратковременная и уже через 60-90 минут большая часть гепарина связывается клетками интимы сосуда. Поэтому для адекватного поддержания гипокоагуляции при болюсном введении гепарин необходимо вводить каждые 1,5-2,5 ч, что очень затруднительно для персонала клиник и часто приводит к геморрагическим осложнениям (относительный риск в 4-7 раз выше, чем при постоянной внутривенной инфузии той же суточной дозы). Практиковавшийся ранее режим внутривенного болюсного введения гепарина через каждые 4 часа вообще является неприемлимым, т.к. в этом случае свертываемость крови подвергается большим колебаниям – от глубокой гипокоагуляции после введения препарата, до нормо- или гиперкоагуляции перед очередным его введением.
Внутримышечное введение гепарина в настоящее время является недопустимым, поскольку при этом в богато васкуляризированной мышечной ткани могут образовываться гематомы, которые не сразу выявляются и могут быть причиной значительных кровопотерь.
В крови гепарин связывается в основном с липопротеинами, а также с фибриногеном, макроглобулинами и альбуминами. Гепарин не проникает через плаценту и в молоко матери, поэтому может применяться при беременности и у кормящих матерей. Гепарин накапливается в макрофагах легких, печени и селезенки, где создается его значительное депо.
Период полуэлиминации гепарина – дозозависимый параметр. При введении дозы 100 ЕД/кг он составляет 1,0 ч; 400 ЕД/кг - 2,5 ч и 800 ЕД/кг - 5 ч. Период полувыведения у мужчин меньше, чем у женщин, он также укорочен у курящих лиц и пациентов с ТЭЛА.
Инактивация гепарина в крови происходит при участии гепариназы печени, а также 4 фактора свертывания крови из a-гранул тромбоцитов. Этот фактор связывает молекулы гепарина и нарушает их способность активировать антитромбин III.
Показания к применению гепарина и режимы базирования. При использовании гепарина с лечебными целями предпочтительным является его внутривенное болюсное введение с последующей постоянной внутривенной инфузией. В случае профилактического применения гепарина, наилучшим, в настоящее время, считается его подкожное введение. Основными показаниями к применению гепарина являются:
1. Лечение острой ТЭЛА. Наиболее эффективным считается внутривенное введение гепарина в виде болюса 5.000-10.000 ЕД с последующей постоянной инфузией со скоростью 1.000-1.500 ЕД/ч в течение 7-10 суток. Лабораторный контроль осуществляется путем определения АЧТВ 4 раза в сутки. К концу первых суток необходимо добиться увеличения АЧТВ в 1,5-2,0 раза выше нормы. По мере достижения стабильных показателей АЧТВ его контроль проводят 1 раз в сутки.
2. Лечение нестабильной стенокардии и острого инфаркта миокарда без зубца Q. Рядом исследований показано, что гепаринотерапия на 93% понижает частоту случаев смерти и нефатального инфаркта миокарда при нестабильной стенокардии. Долгое время полагали, что при этой форме стенокардии единственно возможным является лишь непрерывное внутривенное введение гепарина. Однако, в 1995 г в исследовании SESAIR Study Group было убедительно доказано, что нет разницы в исходах при внутривенном инфузионном и подкожном введении гепарина. В настоящее время подходы к методу гепаринотерапии определяют исходя из классификации степени тяжести стенокардии предложенной E. Braunwald (1989)[3]. При стенокардии IВС и IIВС класса тяжести применяется подкожное введение гепарина по 5.000-15.000 ЕД каждые 8 часов (АЧТВ должно быть более 56 сек). При стенокардии IIIAВС с любым видом девиации сегмента SТ используют внутривенное введение гепарина болюсом по 5.000-10.000 ЕД с последующей капельной инфузией, со скоростью 1.000-1.250 ЕД/ч в течение 3-7 дней.
3. Острый инфаркт миокарда (в дополнение к тромболитической терапии при высоком риске тромбоэмболических осложнений). О высоком риске тромбоэмболических осложнений говорит наличие хотя бы одного из следующих факторов:
· трансмуральный острый инфаркт миокарда передней стенки левого желудочка (особенно при визуализации УЗИ пристеночного тромба);
· большой по объему острый инфаркт миокарда;
· аневризма передней стенки левого желудочка;
· наличие хронической застойной сердечной недостаточности;
· мерцательная аритмия;
· системные или легочные эмболии в анамнезе;
· пожилой возраст;
· наличие осложнений, требующих длительного пребывания на постельном режиме.
Всем этим группам показано проведение гепаринотерапии через 3-24 часа после завершения тромболитической терапии. Длительность гепаринотерапии 3-7 дней. Возможны 2 режима введения: 1) подкожное введение в суточной дозе 25.000-35.000 ЕД разбитой на 3 введения (АЧТВ>56 сек); 2) внутривенное болюсное введение 5.000-10.000 ЕД с последующей инфузией со скоростью 1.000-1.250 ЕД/ч. В случае отсутствия тромболитиков, либо при наличии противопоказаний для их введения, возможно применение гепарина в комбинации с ацетилсалициловой кислотой по одной из вышеприведенных методик, либо однократное болюсное введение в дозе 300 ЕД/кг (однако, в случае применения этого болюса весьма высок риск развития геморрагических осложнений).
4. Тромбоз глубоких вен конечностей (в качестве профилактики и с лечебной целью). Для лечения тромбозов глубоких вен предпочтительным является внутривенное болюсное введение 5.000-10.000 ЕД гепарина с последующей его инфузией со скоростью 1.000-1.500 ЕД/ч в течение 1-5 суток. Менее эффективно подкожное применение гепарина по 15.000-17.000 ЕД каждые 8-12 ч (АЧТВ»56 сек). Применение гепарина для профилактики тромбоза проводят дифференцировано с учетом степени риска:
| СТЕПЕНЬ РИСКА | ВЕДЕНИЕ |
| A. Низкий риск: [ малые хирургические операции продолжительностью менее 30 мин у пациентов старше 40 лет; [ неосложненные хирургические вмешательства у пациентов моложе 40 лет, без риска тромбоэмболических осложнений. | амбулаторное наблюдение |
| B. Средний риск: [ хирургические операции, продолжающиеся более 30 мин у пациентов старше 40 лет; [ пациенты с инфарктом миокарда или сердечной недостаточностью без посттравматических гематом и возрастного риска кровотечений. | гепарин подкожно 5.000 ЕД каждые 12 часов, либо эластическое бинтование конечностей |
| C. Высокий риск: [ пациенты старше 40 лет, подлежащие большим хирургическим вмешательствам и имеющие дополнительные факторы риска тромбоэмболии, за исключением лиц, склонных к постоперационным гематомам или тех пациентов, состояние которых осложнено инфекционным процессом (им показана интермиттирующая пневматическая компрессия). | гепарин 5.000 ЕД подкожно каждые 8 часов |
| D. Очень высокий риск: [ пациенты старше 40 лет с многочисленными факторами риска тромбоэмболических осложнений. | гепарин 5.000 ЕД подкожно каждые 8 ч, либо реополиглюкин в сочетании с интермиттирующей пневматической компрессией |
5.
[1] БОГ – Британское общество гематологов.
[2] АИСЛК – Американский институт сердца, легких и крови.
[3] Согласно E. Braunwald различают 3 класса степени тяжести нестабильной стенокардии.
КЛАСС I(прогрессирующая стенокардия напряжения):
· впервые возникшая стенокардия напряжения менее, чем 2 месяца назад;
· изменение тяжести или частоты (>3 в сутки) ангинозных приступов;
· возникновение резкого снижения толерантности к физнагрузке или необходимости увеличения дозы лекарств необходимых для профилактики или купирования приступов стенокардии напряжения при условии, что в предшествующие 2 месяца у пациента не было приступов стенокардии покоя.
КЛАСС II(подострая стенокардия покоя):
· лица с одним или несколькими ангинозными приступами в покое в течение предшествующего месяца, но не в последние 48 часов.
КЛАСС Ш(острая стенокардия покоя):
· лица с одним или несколькими ангинозными приступами в покое в течение последних 48 часов.
Каждый класс по тяжести состояния подразделяется на 3 подкласса:
Подкласс А (вторичная нестабильная стенокардия) – стенокардия, которая развилась из-за внекоронарных причин, усугубивших ишемию миокарда, вследствие снижения доставки кислорода к нему: гипотония, кризовое течение артериальной гипертензии, анемия, лихорадка, инфекционное заболевание, тахиаритмия из-за дыхательной недостаточности или нарушения функции щитовидной железы, эмоциональный стресс и др.
Подкласс В(первичная нестабильная стенокардия) – стенокардия, обусловленная прогрессированием коронарных причин: увеличение степени стеноза, появление нарушений ритма и др.
Подкласс С(постинфаркгная нестабильная стенокардия) – стенокардия, возникшая в первые 2 недели после острого инфаркта миокарда.
Кроме того, в зависимости от изменений сегмента 5Т нестабильная стенокардия по возрастанию тяжести может быть:
· без изменений сегмента SТ;
· с преходящей депрессией сегмента SТ и/или инверсией зубца Т;
· с преходящей элевацией сегмента SТ (в том числе вариантная стенокардия).
Дата добавления: 2016-06-05; просмотров: 2386;











