Основные газовые законы
Состояние газа характеризуется его температурой, давлением и объёмом, взаимосвязь между которыми выражается соответствующими газовыми законами.
Закон Бойля-Мариотта:При постоянной температуре ( 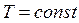 ) для данной массы газа произведение давления газа
) для данной массы газа произведение давления газа 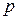 на его объём
на его объём 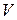 есть величина постоянная:
есть величина постоянная:
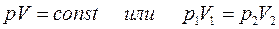 .
. 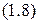
Закон Гей-Люссака:При постоянном давлении ( 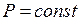 ) объём газа данной массы прямо пропорционален его абсолютной температуре:
) объём газа данной массы прямо пропорционален его абсолютной температуре: 
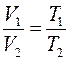
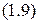
Закон Шарля:При постоянном объёме 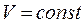 давление газа данной массы прямо пропорционально его абсолютной температуре:
давление газа данной массы прямо пропорционально его абсолютной температуре:
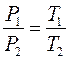
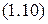
Взаимосвязь всех трёх параметров ( 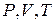 ) для данной массы газа выражает объединённый газовый закон (уравнение Клапейрона):
) для данной массы газа выражает объединённый газовый закон (уравнение Клапейрона):
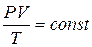 или
или 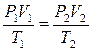
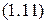
Если уравнение Клапейрона записать для стандартных условий5, т.е.
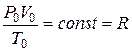 ,
, 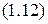
то можно видеть, что для одного моля газа произведение давления на объём, делённое на абсолютную температуру, есть величина постоянная. Она называется газовой постоянной 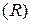 . Её численное значение зависит от того, в каких единицах выражают давление и объём. В соответствии с международной системой физических величин
. Её численное значение зависит от того, в каких единицах выражают давление и объём. В соответствии с международной системой физических величин 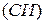 объём выражается в
объём выражается в 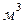 , а давление – в паскалях, то
, а давление – в паскалях, то
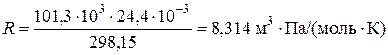 .
.
Произведение объёма газа на давление имеет размерность энергии: 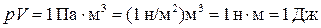 . Отсюда
. Отсюда
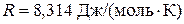 .
.
Применительно к некоторому числу 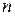 молей газа и произвольным условиям уравнение
молей газа и произвольным условиям уравнение 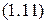 принимает вид:
принимает вид:
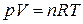 .
. 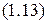
Так как число молей газа n можно представить как частное от деления массы газа 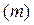 на мольную массу
на мольную массу 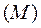 :
:
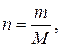
то уравнение 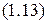 перепишется в виде:
перепишется в виде:
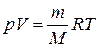 .
. 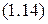
Это уравнение вывел Д.И. Менделеев в 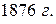 , и теперь его называют уравнением Клапейрона–Менделеева.
, и теперь его называют уравнением Клапейрона–Менделеева.
Закон Авогадро:В равных объёмах любых газов, взятых при одинаковых условиях 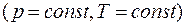 содержится одинаковое число молекул.
содержится одинаковое число молекул.
Из закона Авогадро вытекает два следствия:
1. Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объём.
Число Авогадро – число частиц в 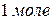 любого вещества при
любого вещества при 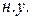 равно
равно 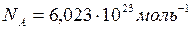 .
.
Молярный объём – объём одного моля любого газа при нормальных условиях 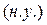 равен
равен 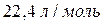 .
.
2. Относительная плотность одного газа по другомуравна отношению их молярных масс 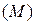 или относительных молекулярных масс
или относительных молекулярных масс 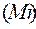 .
.
Так как относительная плотность газа 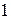 по газу
по газу 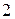
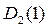 показывает отношение плотности одного газа
показывает отношение плотности одного газа 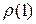 к плотности другого газа
к плотности другого газа 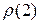 :
:
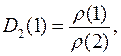
а плотность 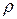 любого газа есть отношение:
любого газа есть отношение:
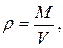
тогда 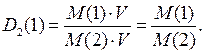
Часто плотность различных газов определяют по отношению к водороду 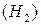 как самому легкому из всех газов или по отношению к воздуху. Относительная плотность любого газа
как самому легкому из всех газов или по отношению к воздуху. Относительная плотность любого газа 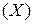 по водороду:
по водороду:
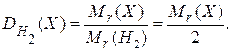
Воздух это смесь газов ( 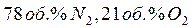 и
и  других газов), средняя относительная молекулярная масса которого равна 29. Поэтому относительная плотность любого газа (Х) по воздуху:
других газов), средняя относительная молекулярная масса которого равна 29. Поэтому относительная плотность любого газа (Х) по воздуху:
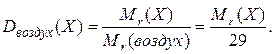
Парциальное давление газа:Парциальным давлением газа в смеси называется давление, которое производил бы газ, занимая при тех же условиях объём всей газовой смеси. Отсюда вытекает закон парциальных давлений:Общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь:

где 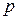 - общее давление газовой смеси,
- общее давление газовой смеси, 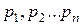 - парциальные давления составляющих её частей.
- парциальные давления составляющих её частей.
Если газ собран над жидкостью, которая обладает собственным давлением пара, то при расчетах следует иметь в виду, что его давление является парциальным и равно разности общего давления газовой смеси и парциального давления пара жидкости. Например, какой-либо газ собирают над водой, которая является одним из реагирующих веществ или просто запирающей жидкостью, и давление в сосуде составляет  при
при 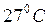 . Но давление паров воды при этой температуре равно
. Но давление паров воды при этой температуре равно 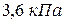 , тогда парциальное давление газа
, тогда парциальное давление газа 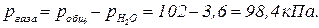
Дата добавления: 2016-06-05; просмотров: 16992;











