Электроотрицательности атомов (по В. В. Зуеву) для различных валентных состояний и в различных единицах
| Атом (валентность) | ЭО, эВ | ЭО по шкале Ж.-П. | ЭО, кДж/моль | ЭО, кДж/г-а | ЭО, кДж/см3 в твердом теле |
| H(I) | 13,6 | 2,58 | 1312,21 | 1301,87 | 98,94 |
| He(II) | 25,89 | 4,92 | 2498,02 | 624,1 | - |
| Li(I) | 5,39 | 1,02 | 520,06 | 74,93 | 40,01 |
| Be(II) | 9,21 | 1,75 | 888,64 | 98,6 | 182,41 |
| B(III) | 11,17 | 2,12 | 1077,75 | 99,7 | 184,22 |
| C(IV) | 13,88 | 2,64 | 1339,23 | 111,5 | 391,7 |
| N(III) | 15,05 | 2,86 | 1452,11 | 103,67 | 106,36 |
| N(V) | 16,81 | 3,19 | 1621,93 | 115,8 | - |
| O(II) | 15,59 | 2,96 | 1504,22 | 94,01 | 188,02 |
| O(IV) | 17,21 | 3,27 | 1660,52 | 103,78 | - |
| O(VI) | 19,1 | 3,63 | 1842,88 | 115,18 | - |
| F(I) | 17,42 | 3,31 | 1680,77 | 88,46 | 134,11 |
| F(III) | 18,6 | 3,53 | 1794,64 | 94,45 | - |
| F(V) | 20,09 | 3,82 | 1938,40 | 102,02 | - |
| F(VII) | 21,87 | 4,16 | 2110,15 | 111,06 | - |
| Ne(VIII) | 25,83 | 4,91 | 2492,23 | 123,5 | - |
| Na(I) | 5,14 | 0,98 | 495,94 | 21,56 | 20,93 |
| Mg(II) | 7,58 | 1,44 | 731,36 | 30,09 | 52,3 |
| Al(III) | 8,29 | 1,58 | 799,87 | 29,65 | 79,91 |
| Si(IV) | 9,69 | 1,84 | 934,95 | 33,29 | 77,53 |
| P(III) | 10,14 | 1,93 | 978,37 | 31,59 | 57,49 |
| P(V) | 11,25 | 2,14 | 1085,47 | 35,04 | - |
| S(II) | 11,02 | 2,09 | 1063,28 | 33,16 | 68,64 |
| S(IV) | 11,36 | 2,16 | 1096,08 | 34,18 | - |
| S(VI) | 12,44 | 2,36 | 1200,29 | 37,43 | - |
| Cl(I) | 12,97 | 2,46 | 1251,42 | 35,3 | 71,65 |
| Cl(III) | 12,73 | 2,42 | 1228,27 | 34,65 | - |
| Cl(V) | 13,01 | 2,47 | 1255,28 | 35,41 | - |
| Cl(VII) | 13,92 | 2,64 | 1343,09 | 37,88 | - |
| Ar(VIII) | 15,5 | 2,95 | 1495,53 | 37,44 | - |
| K(I) | 4,34 | 0,82 | 418,75 | 10,71 | 9,23 |
| Ca(II) | 6,02 | 1,14 | 580,85 | 14,49 | 22,46 |
| Sc(III) | 7,09 | 1,35 | 684,09 | 15,22 | 45,51 |
| Ti(II) | 6,81 | 1,29 | 657,07 | 13,72 | - |
| Ti(IV) | 8,45 | 1,61 | 815,30 | 17,02 | 77,27 |
| V(III) | 7,91 | 1,50 | 763,20 | 14,98 | - |
| V(IV) | 8,94 | 1,7 | 862,58 | 16,93 | - |
| V(V) | 9,76 | 1,85 | 941,7 | 18,49 | 112,97 |
| Cr(II) | 7,51 | 1,43 | 724,61 | 13,93 | - |
| Cr(III) | 8,45 | 1,61 | 815,31 | 15,68 | - |
| Cr(IV) | 9,52 | 1,81 | 918,55 | 17,66 | - |
| Cr(VI) | 11,3 | 2,15 | 1090,29 | 20,97 | 150,77 |
| Mn(II) | 7,63 | 1,45 | 736,19 | 13,4 | - |
| Mn(III) | 8,83 | 1,68 | 851,97 | 15,51 | - |
| Mn(IV) | 9,93 | 1,89 | 958,11 | 17,44 | 129,75 |
| Mn(V) | 10,99 | 2,09 | 1060,38 | 19,3 | 143,6 |
| Mn(VII) | 12,66 | 2,41 | 1221,51 | 22,23 | - |
| Fe(II) | 8,0 | 1,52 | 771,89 | 13,82 | - |
| Fe(III) | 8,73 | 1,66 | 842,32 | 15,08 | - |
| Fe(IV) | 10,05 | 1,91 | 969,68 | 17,36 | 136,69 |
| Fe(VI) | 12,19 | 2,32 | 1176,16 | 21,06 | - |
| Fe(VIII) | 13,83 | 2,63 | 1334,4 | 23,89 | 391,8 |
| Co(II) | 8,19 | 1,56 | 790,22 | 13,41 | - |
| Co(III) | 9,18 | 1,74 | 885,74 | 15,03 | - |
| Co(IV) | 10,2 | 1,94 | 984,16 | 16,7 | 133,77 |
| Co(IX) | 15,05 | 2,86 | 1452,11 | 24,64 | - |
| Ni(II) | 8,35 | 1,59 | 805,66 | 13,72 | - |
| Ni(III) | 9,59 | 1,82 | 925,3 | 15,76 | 140,3 |
| Ni(IV) | 10,69 | 2,03 | 1031,44 | 17,57 | 156,41 |
| Ni(VIII) | 14,85 | 2,82 | 1432,82 | 24,41 | - |
| Ni(X) | 16,34 | 3,1 | 1576,58 | 26,86 | - |
| Cu(I) | 7,72 | 1,47 | 744,87 | 11,72 | 105,01 |
| Cu(II) | 8,93 | 1,7 | 861,62 | 13,56 | - |
| Cu(III) | 10,05 | 1,91 | 969,68 | 15,26 | 136,73 |
| Cu(V) | 12,3 | 2,34 | 1186,78 | 18,68 | - |
| Cu(VII) | 14,01 | 2,66 | 1351,77 | 21,27 | - |
| Zn(II) | 9,18 | 1,74 | 885,74 | 13,55 | 96,65 |
| Zn(VI) | 13,88 | 2,64 | 1339,23 | 20,48 | - |
| Ga(III) | 8,83 | 1,68 | 851,97 | 12,22 | 72,18 |
| Ge(IV) | 9,67 | 1,84 | 933,02 | 12,85 | 68,4 |
| As(III) | 9,53 | 1,81 | 919,51 | 12,27 | 70,92 |
| As(V) | 10,74 | 2,04 | 1036,26 | 13,83 | - |
| Se(II) | 10,17 | 1,93 | 981,26 | 12,43 | 59,54 |
| Se(IV) | 10,43 | 1,98 | 1006,35 | 12,75 | - |
| Se(VI) | 11,54 | 2,19 | 1113,45 | 14,1 | - |
| Br(V) | 11,69 | 2,22 | 1127,92 | 14,12 | - |
| Br(VII) | 12,55 | 2,38 | 1210,9 | 15,15 | - |
| Kr(VIII) | 13,67 | 2,6 | 1318,96 | 15,74 | - |
| Rb(I) | 4,18 | 0,79 | 403,31 | 4,72 | 7,23 |
| Sr(II) | 5,6 | 1,06 | 540,32 | 6,17 | 15,67 |
| Y(III) | 6,44 | 1,22 | 621,37 | 6,99 | 31,24 |
| Zr(IV) | 7,51 | 1,43 | 724,61 | 7,94 | 51,66 |
| Nb(III) | 7,73 | 1,47 | 745,84 | 8,03 | - |
| Nb(IV) | 8,19 | 1,56 | 790,22 | 8,51 | - |
| Nb(V) | 8,56 | 1,63 | 825,92 | 8,89 | 68,82 |
| Mo(IV) | 9,12 | 1,73 | 879,95 | 9,17 | 93,72 |
| Mo(VI) | 9,98 | 1,9 | 962,93 | 10,04 | 102,61 |
| Tc(V) | 9,57 | 1,82 | 923,37 | 9,34 | 107,41 |
| Tc(VII) | 10,56 | 2,01 | 1018,89 | 10,3 | 118,45 |
| Ru(II) | 7,83 | 1,49 | 755,49 | 7,47 | - |
| Ru(III) | 8,59 | 1,63 | 828,81 | 8,2 | - |
| Ru(IV) | 9,38 | 1,78 | 905,04 | 8,95 | 110,71 |
| Ru(VI) | 10,62 | 2,02 | 1024,68 | 10,14 | 125,43 |
| Ru(VIII) | 11,6 | 2,2 | 1119,24 | 11,07 | - |
| Rh(II) | 7,71 | 1,46 | 743,91 | 7,23 | - |
| Rh(III) | 8,78 | 1,67 | 847,15 | 8,23 | - |
| Rh(IV) | 9,46 | 1,8 | 912,76 | 8,87 | 110,08 |
| Pd(II) | 9,02 | 1,71 | 870,3 | 8,18 | 98,32 |
| Pd(IV) | 10,32 | 1,96 | 995,74 | 9,36 | 112,51 |
| Ag(I) | 7,57 | 1,43 | 730,4 | 6,77 | 71,08 |
| Ag(II) | 9,16 | 1,74 | 883,81 | 8,19 | - |
| Ag(III) | 10,12 | 1,92 | 976,44 | 9,05 | 95,03 |
| Cd(II) | 8,72 | 1,66 | 841,36 | 7,48 | 64,7 |
| In(III) | 8,18 | 1,55 | 789,25 | 6,87 | 50,22 |
| Sn(II) | 7,33 | 1,39 | 707,24 | 5,96 | 43,57 |
| Sn(IV) | 9,12 | 1,73 | 879,95 | 7,41 | - |
| Sb(III) | 8,42 | 1,6 | 812,41 | 6,67 | 44,63 |
| Sb(V) | 9,81 | 1,86 | 946,53 | 7,77 | - |
| Te(II) | 9,15 | 1,74 | 882,85 | 6,92 | 43,18 |
| Te(IV) | 9,54 | 1,81 | 920,48 | 7,21 | - |
| Te(VI) | 10,86 | 2,06 | 1047,84 | 8,21 | - |
| I(III) | 10,33 | 1,96 | 996,7 | 7,85 | - |
| I(V) | 11,14 | 2,12 | 1074,85 | 8,47 | - |
| I(VII) | 12,06 | 2,29 | 1163,62 | 9,17 | - |
| Xe(VIII) | 12,65 | 2,4 | 1220,55 | 9,3 | - |
| Cs(I) | 3,89 | 0,74 | 375,33 | 2,82 | 5,28 |
| Ba(II) | 5,41 | 1,03 | 521,99 | 3,8 | 13,66 |
| La(III) | 5,91 | 1,12 | 570,23 | 4,11 | 25,26 |
| Ce(III) | 6,44 | 1,22 | 621,37 | 4,43 | 36,5 |
| Ce(IV) | 7,12 | 1,35 | 686,98 | 4,9 | - |
| Pr(III) | 5,97 | 1,13 | 576,02 | 4,09 | 27,7 |
| Nd(III) | 6,07 | 1,15 | 585,67 | 4,06 | 28,45 |
| Pm(III) | 6,14 | 1,17 | 592,42 | 4,09 | 29,53 |
| Sm(III) | 6,32 | 1,2 | 609,79 | 4,05 | 30,46 |
| Eu(II) | 5,64 | 1,07 | 544,18 | 3,58 | - |
| Eu(III) | 6,51 | 1,24 | 628,12 | 4,13 | 21,65 |
| Gd(III) | 6,36 | 1,21 | 613,65 | 3,9 | 30,81 |
| Tb(III) | 6,3 | 1,2 | 607,86 | 3,82 | 31,43 |
| Dy(III) | 6,45 | 1,23 | 622,33 | 3,83 | 32,75 |
| Ho(III) | 6,51 | 1,24 | 628,12 | 3,81 | 33,51 |
| Er(II) | 6,03 | 1,15 | 581,81 | 3,48 | 31,55 |
| Tm(III) | 6,7 | 1,27 | 646,46 | 3,83 | 35,7 |
| Yb(II) | 6,17 | 1,17 | 595,32 | 3,44 | 23,96 |
| Yb(III) | 6,95 | 1,32 | 670,58 | 3,88 | - |
| Lu(III) | 6,46 | 1,23 | 623,3 | 3,56 | 35,03 |
| Hf(IV) | 7,95 | 1,51 | 767,06 | 4,3 | 57,23 |
| Ta(III) | 7,71 | 1,46 | 743,91 | 4,11 | - |
| Ta(V) | 8,08 | 1,53 | 779,61 | 4,31 | 71,78 |
| W(IV) | 8,4 | 1,6 | 810,48 | 4,41 | - |
| W(VI) | 8,89 | 1,69 | 857,76 | 4,67 | 90,13 |
| Re(V) | 8,91 | 1,69 | 859,69 | 4,62 | - |
| Re(VI) | 9,23 | 1,75 | 890,57 | 4,78 | 100,48 |
| Re(VII) | 9,52 | 1,81 | 918,55 | 4,93 | - |
| Os(II) | 8,6 | 1,63 | 829,78 | 4,36 | - |
| Os(IV) | 8,88 | 1,69 | 856,8 | 4,5 | 101,65 |
| Os(VI) | 9,58 | 1,82 | 924,34 | 4,86 | 109,79 |
| Os(VIII) | 10,32 | 1,96 | 995,74 | 5,24 | - |
| Ir(III) | 8,9 | 1,69 | 858,73 | 4,47 | - |
| Ir(IV) | 9,11 | 1,73 | 878,99 | 4,57 | 102,46 |
| Ir(VI) | 9,96 | 1,89 | 961,0 | 5,0 | 112,1 |
| Pt(II) | 9,11 | 1,73 | 878,99 | 4,51 | - |
| Pt(IV) | 9,54 | 1,81 | 920,48 | 4,72 | 101,24 |
| Pt(VI) | 10,27 | 1,95 | 990,91 | 5,08 | 108,97 |
| Au(I) | 9,22 | 1,75 | 889,6 | 4,52 | 87,33 |
| Au(II) | 9,74 | 1,85 | 939,77 | 4,77 | 92,16 |
| Au(III) | 9,82 | 1,86 | 947,5 | 4,81 | 92,93 |
| Hg(I) | 10,44 | 1,98 | 1007,31 | 5,02 | 68,0 |
| Hg(II) | 9,91 | 1,88 | 956,18 | 4,77 | 64,61 |
| Tl(I) | 6,11 | 1,16 | 589,53 | 2,88 | 34,13 |
| Tl(III) | 8,75 | 1,66 | 844,25 | 4,13 | 48,95 |
| Pb(II) | 7,46 | 1,42 | 719,79 | 3,47 | 39,38 |
| Pb(IV) | 8,83 | 1,68 | 851,97 | 4,11 | - |
| Bi(III) | 8,47 | 1,61 | 817,23 | 3,91 | 38,12 |
| Bi(V) | 9,59 | 1,82 | 925,3 | 4,43 | - |
| Po(II) | 9,07 | 1,72 | 875,13 | 4,19 | 39,05 |
| Po(IV) | 9,18 | 1,74 | 885,74 | 4,24 | - |
| Po(VI) | 10,15 | 1,93 | 979,33 | 4,69 | - |
| At(VII) | 10,78 | 2,05 | 1040,12 | 4,95 | - |
| Rn(VIII) | 11,52 | 2,19 | 1111,52 | 5,01 | - |
| Fr(I) | 3,98 | 0,76 | 384,01 | 1,72 | - |
| Ra(II) | 5,18 | 0,98 | 499,8 | 2,21 | 19,01 |
| Ac(III) | 6,4 | 1,22 | 617,51 | 2,72 | 27,36 |
| Th(IV) | 6,87 | 1,31 | 662,86 | 2,86 | 33,52 |
| U(IV) | 7,81 | 1,48 | 753,55 | 3,17 | 60,07 |
| U(VI) | 9,26 | 1,76 | 892,5 | 3,75 | 71,05 |
| Np(III) | 6,36 | 1,21 | 613,65 | 2,59 | 52,45 |
ПРИМЕЧАНИЕ. Величины электроотрицательностей атомов вычислены из соответствующих потенциалов ионизации по формуле (Зуев, 1990):
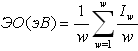
где w - валентность атома, Iw - потенциал ионизации соответствующей валентности.
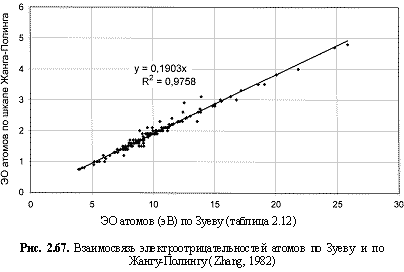
Перевод полученных по этой формуле величин из электрон-вольтов в относительные электроотрицательности по шкале Жанга-Полинга (Zhang, 1982) осуществлен посредством коэффициента 0,19 (рис. 2.67), а в единицы кДж/моль - посредством коэффициента 96,486 кДж/моль.
Делением на атомные веса элементов (М, г/моль) величины ЭО кДж/моль трансформированы в величины ЭО кДж/г, которые умножением на плотность (ρ, г/см3) гомоатомного кристалла переведены в величины ЭО кДж/см3.
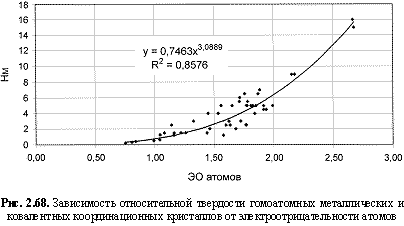
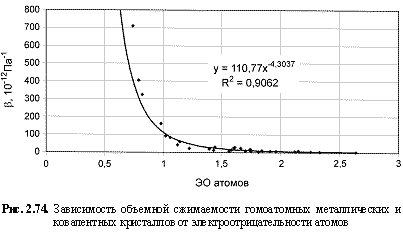
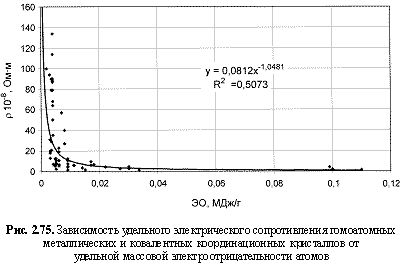
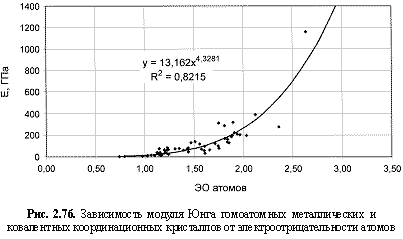
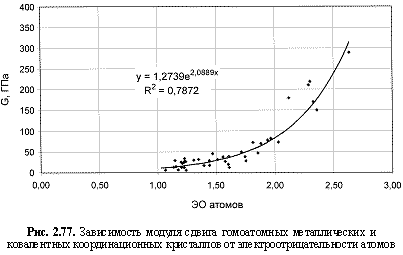
НМ = 0,75ЭО3; (2.110)
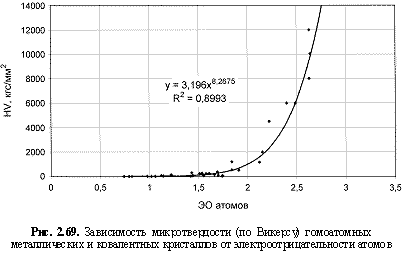
HV (кгс/мм2) = 3,2ЭО8.27; (2.111)
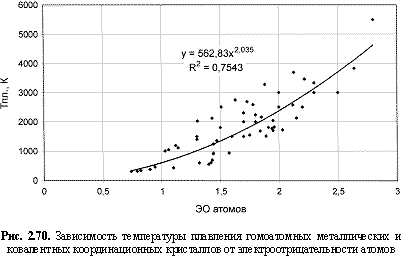
Тпл., К = 563ЭО2; (2.112)
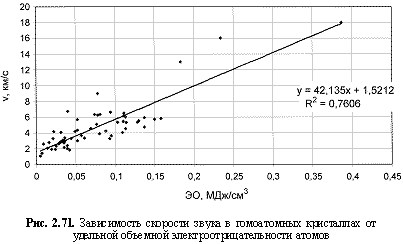
v (км/с) = 42,14ЭО(МДж/см3) + 1,52; (2.113)
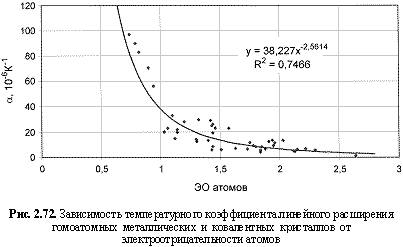
αl (10-6 K-1) = 38,23ЭО-2.56; (2.114)
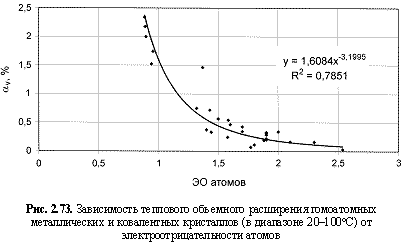
αv (%) = 1,61ЭО-3.2; (2.115)
B (10-12 Па-1) = 120,4ЭО-4.53; (2.116)
λ (Вт/(м∙К)) = 1653ЭО(МДж/см3); (2.117)
ρ (10-8 Ом∙м) = 0,08[ЭО(МДж/г)]-1.05; (2.118)
Е (ГПа) = 12,96ЭО4.5; (2.119)
G (ГПа) = 1,274е2.09ЭО; (2.120)
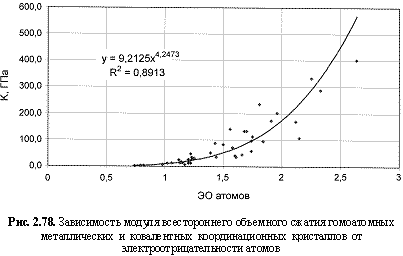
К (ГПа) = 9,21ЭО4.25; (2.121)
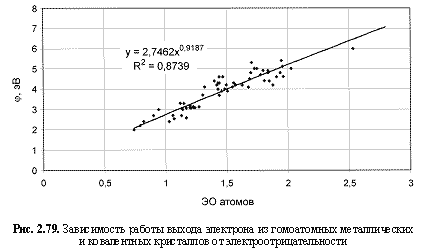
φ (эВ) = 2,75ЭО0.92; (2.122)
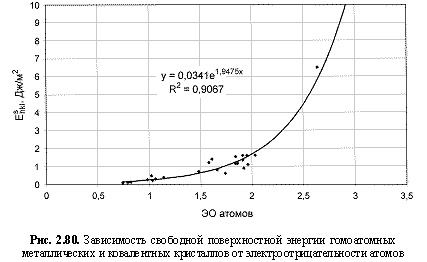
Eshkl (Дж/м2) = 0,034е1.95ЭО; (2.123)
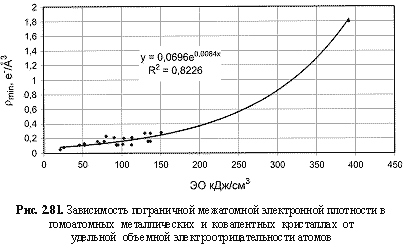
ρmin (e-/Å3) = 0,07е0.0084ЭО(кДж/см3); (2.124)
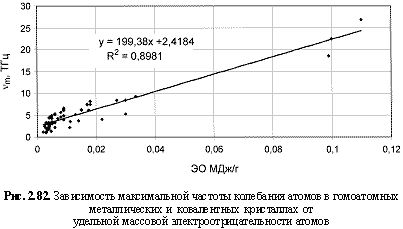
vm (ТГц) = 199,4ЭО(МДж/г) + 2,42; (2.125)
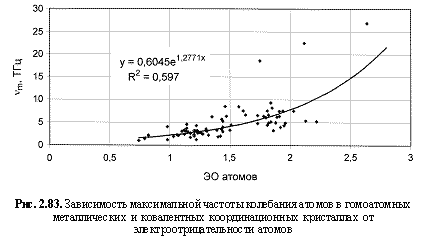
vm (ТГц) = 0,605е1.28ЭО; (2.126)
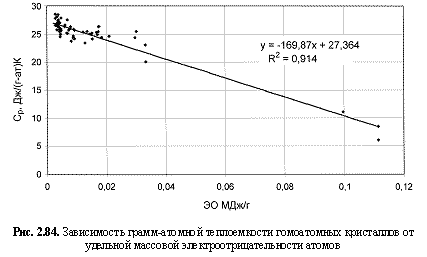
Ср (Дж/(г-а)К) = -170ЭО(МДж/г) + 27,36. (2.127)
Обратим внимание на то, что в выведенных формулах, обеспечивающих довольно высокие параметры достоверности аппроксимации R2, фигурируют различные электроотрицательности (таблица 2.12): относительные (безразмерные) в шкале Жанга-Полинга (ЭО), удельные массовые (ЭО МДж/г) и удельные объемные (ЭО МДж/см3 или ЭО кДж/см3). Именно поэтому размерности электроотрицательностей указаны в формулах (что обычно не практикуется в научных изданиях). Использование удельных величин электроотрицательностей повышает достоверность аппроксимации R2, что следует из сравнения двух формул максимальной частоты колебаний атомов в кристаллах (рис. 2.82 и 2.83). Понятно, что получение удельных электроотрицательностей в соответствующих единицах возможно лишь при условии, если исходная электроотрицательность имеет размерность энергии (эВ). По этой причине и была выбрана шкала энергетических (ионизационных) электроотрицательностей атомов (таблица 2.12).
Предлагаемые формулы с достоверностью до 80-90% позволяют оценивать свойства гомоатомныхкоординационных кристаллических соединений.
Оценка свойств более сложных гетероатомныхкристаллических соединений с применением электроотрицательностей атомов в принципе также возможна, но представляет отдельную самостоятельную проблему, которая здесь подробно не рассматривается и будет продемонстрирована лишь на двух примерах - вычисления твердости и температуры плавления.
Для оценки твердости гетероатомных кристаллических соединений необходимо внести следующие два изменения в формулу (2.110). Во-первых, в качестве параметра электроотрицательности сложного соединения рекомендуется вычислять среднегеометрическую величину <ЭО> из электроотрицательностей атомов, образующих это соединение. Например, для кристалла АnBm <ЭО> = (ЭОnA∙ЭОmB)1/(n+m). И, во-вторых, в силу различия электроотрицательностей атомов гетероатомного соединения и соответственно отклонения химической связи от ковалентного типа предлагается учесть степень ковалентности в форме соответствующего параметра р*, и формула (2.110) трансформируется в формулу:
HM = 0,75ЭО3р*. (2.128)
В результате многочисленных расчетов было установлено, что р* = (1-fi2)1/2 для кристаллов, удовлетворяющих условию 0,6≤fi<1, и р* = (1-fi) для кристаллов, удовлетворяющих условию 0,6>fi>0 (fi - степень ионности соединений).
Важно подчеркнуть, что обе формулы, строго говоря, применимы к координационным кристаллам с ковалентными, ионными и металлическими межатомными связями и не применимы к молекулярным соединениям, обладающим островным, цепочечным или слоистым мотивами структур. По известному кристаллохимическому правилу твердость подобных кристаллов определяется прочностью слабых молекулярных связей, поскольку при разрушении таких кристаллов прочные межатомные связи не нарушаются.
В качестве примера вычислим твердость форстерита Mg2SiO4, который лишь формально относится к островным силикатам, а фактически является сложным координационным кристаллическим соединением. Приняв ЭО(Mg) = 1,44, ЭО(Si) = 1,84, ЭО(O) = 3,27 и fi = 0,7, находим <ЭО> = (1,442x1,84x3,274)1/7 = 2,38 и далее по формуле (2.128) - НМ = 0,75x2,383(1-0,72)1/2 = 7,2 что находится в удовлетворительном согласии со справочной величиной (около 7,0 по разным источникам).
В случае циркона ZrSiO4 c параметрами ЭО(Zr) = 1,43, ЭО(Si) = 1,84, ЭО(О) = 3,27 и fi = 0,8 находим <ЭО> = (1,43x1,84x3,274)1/6 = 2,59 и НМ = 7,8, что близко к справочной твердости циркона (7,5).
И еще один, более сложный пример. Для гроссуляра Ca3Al2Si3O12 с использованием ЭО(Са) = 1,14, ЭО(Al) = 1,58, ЭО(Si) = 1,84, ЭО(О) = 3,27 и fi = 0,7 находим <ЭО> = 2,38 и НМ = 7,2 (справочная твердость 7-7,5). Другие примеры вычисления твердости кристаллов по предлагаемой методике приведены в таблице 2.13.
Таблица 2.13
Результаты расчета твердости и температуры плавления координационных и квазикоординационных (слабо анизодесмических) кристаллов с высокими параметрами ионности (fi≥0,6)
| Кристалл | <ЭО> | fi | НМ | Тпл, К | ||
| Расчет | Эксперимент | Расчет | Эксперимент | |||
| LiH | 1,8 | 0,7 | 3,1 | 3,5 | - | |
| NaH | 1,78 | 0,8 | 2,5 | 2,5-3 | - | |
| MgH2 | 2,2 | 0,9 | 3,5 | 3,5-4 | - | |
| CaH2 | 2,1 | 0,94 | 2,4 | 2,5 | ||
| LiF | 2,275 | 0,9 | 3,8 | |||
| LiCl | 1,745 | 0,8 | 2,4 | 2,5 | ||
| LiBr | 1,62 | 0,75 | 2,1 | 2-2,5 | ||
| NaF | 2,255 | 0,9 | 3,7 | 3,5 | ||
| NaCl | 1,725 | 0,85 | ||||
| NaBr | 1,6 | 0,8 | 1,8 | |||
| NaI | 1,55 | 0,75 | 1,85 | |||
| KCl | 1,645 | 0,85 | 1,75 | 1,75 | ||
| KBr | 1,52 | 0,75 | 1,74 | 1,75 | ||
| AgF | 2,25 | 0,97 | 2,1 | 2-2,5 | ||
| AgCl | 1,95 | 0,93 | ||||
| AgBr | 1,825 | 0,93 | 1,7 | |||
| AgI | 1,775 | 0,9 | 1,8 | 1,5-2 | ||
| CsI | 1,43 | 0,8 | 1,3 | 1-1,5 | ||
| TlF | 2,02 | 0,95 | 1,9 | 2,0 | ||
| TlBr | 1,605 | 0,85 | 1,6 | 1,5 | ||
| TlI | 1,57 | 0,85 | 1,5 | 1,5 | ||
| MgF2 | 2,83 | 0,95 | 5,3 | 4,5-5 | ||
| MnF2 | 2,62 | 0,96 | 3,8 | 4,0 | ||
| FeF2 | 2,66 | 0,94 | 4,8 | 4,5 | ||
| CaF2 | 2,73 | 0,95 | 4,8 | |||
| CaCl2 | 2,03 | 0,9 | 2,7 | 2,5 | ||
| YF3 | 2,71 | 0,94 | 5,1 | 4,0-5,0 | ||
| YCl3 | 2,07 | 0,9 | 2,9 | 3,0 | ||
| YI3 | 1,85 | 0,75 | 3,1 | 3,0 | ||
| FeF3 | 2,92 | 0,96 | 5,2 | 5,0 | ||
| SiO2 | 2,25 | 0,72 | 5,9 | 6,0 | ||
| Cu2O | 2,19 | 0,85 | 4,1 | 4,0 | ||
| CuO | 2,36 | 0,9 | 4,3 | 4,5 | ||
| ZnO | 2,38 | 0,85 | 5,3 | 5,0 | 1533 (разл.) | |
| BeO | 2,39 | 0,6 | 8,2 | 7,0-9,0 | ||
| MgO | 2,17 | 0,6 | 6,1 | 6,0 | ||
| MnO | 2,36 | 0,85 | 5,2 | 5-5,5 | ||
| NiO | 2,43 | 0,8 | 6,5 | |||
| CdO | 2,33 | 0,85 | 5,0 | 5,0 | ||
| TiO2 | 2,58 | 0,85 | 6,8 | 7,0 | ||
| SnO2 | 2,64 | 0,85 | 7,3 | 7,0 | ||
| UO2 | 2,43 | 0,8 | 6,5 | 6,5 | ||
| Al2O3 | 2,594 | 0,75 | 8,7 | |||
| Ti2O3 | 2,37 | 0,75 | 6,6 | 6,5 | ||
| Cr2O3 | 2,46 | 0,7 | 8,0 | 8,5 | ||
| V2O3 | 2,39 | 0,7 | 7,3 | 7,5 | ||
| Fe2O3 | 2,49 | 0,85 | 6,1 | 6,5 | ||
| Mn2O3 | 2,505 | 0,8 | 7,1 | 7,0 | - | |
| Bi2O3 | 2,46 | 0,95 | 3,5 | 4,0 | ||
| Ce2O3 | 2,2 | 0,6 | 6,4 | 6,5 | ||
| Fe3O4 | 2,41 | 0,85 | 5,5 | 5,0-6,0 | ||
| Mn3O4 | 2,41 | 0,83 | 5,9 | 6,0 | ||
| BeAl2O4 | 2,62 | 0,8 | 8,1 | 8,5 | ||
| MgAl2O4 | 2,526 | 0,75 | ||||
| ZnAl2O4 | 2,57 | 0,8 | 7,6 | |||
| FeCr2O4 | 2,546 | 0,83 | 6,9 | 6,75 | ||
| CaFe2O4 | 2,32 | 0,85 | 4,9 | 5,0 | ||
| CaTiO3 | 2,3 | 0,7 | 6,5 | 6,5 | ||
| MgTiO3 | 2,57 | 0,87 | 6,9 | 7,0 | ||
| MnTiO3 | 2,41 | 0,85 | 6,9 | 6,5-7,0 | ||
| FeTiO3 | 2,43 | 0,85 | 5,7 | 6,25 | ||
| MgSiO3 | 2,47 | 0,85 | 6,0 | 6,5 | ||
| CaSiO3 | 2,36 | 0,85 | 5,2 | 5,5 | ||
| CaMgSi2O6 | 2,42 | 0,85 | 5,6 | 6,0 | ||
| FeWO4 | 2,41 | 0,85 | 5,5 | 5,5 | - | |
| MgWO4 | 2,39 | 0,85 | 5,4 | 5,5 | ||
| Be2SiO4 | 2,52 | 0,8 | 7,2 | 7,5 | ||
| Na2SiO3 | 1,99 | 0,8 | 3,5 | 3,5 | ||
| Al2SiO5 | 2,54 | 0,85 | 6,5 | 6,0-7,0 | ||
| Y2SiO5 | 2,38 | 0,75 | 6,7 | 6,5 | ||
| Al6Si2O13 | 2,56 | 0,8 | 7,5 | 7,5-8,0 | ||
| MnMn6SiO12 | 2,5 | 0,85 | 6,2 | 6,5 | ||
| Al2SiO4F2 | 2,65 | 0,82 | 8,0 | 8,0 | 1500 (разл.) | |
| Mg7Si8O22(OH)2 | 2,49 | 0,83 | 6,5 | 6,5 | ||
| KMg3AlSi3O10(OH)2 | 2,35 | 0,85 | ¾ | ¾ |
ПРИМЕЧАНИЕ. В расчетах по формулам (2) и (4) параметр ковалентности принят равным p* = (1-fi2)1/2.
Аналогичным образом можно оценивать температуры плавления гетероатомных (сложных) кристаллов с учетом среднегеометрической электроотрицательности атомов и параметра ковалентности:
Тпл., К = 563ЭО2р*, (2.129)
где параметр ковалентности р* принимает в зависимости от ионности fi те же значения, что и в формуле (2.128).
Расчеты температур плавления по этой формуле приведены в таблице 2.13.
В таблице 2.14 даны примеры оценки относительной твердости и температуры плавления для комплексных кристаллических соединений, а в таблице 2.15 - для кристаллов (главным образом сульфидов и их аналогов) с параметрами ионности fi<0,6.
Таблица 2.14
Дата добавления: 2017-09-01; просмотров: 1055;











