Схема фазовых превращений двух- и многокомпонентных систем
С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают свои особенности. В качестве примера на рис. 3.3 приведена зависимость «объем – давление» для смеси пентана и гептана с массовой концентрацией последнего 52,4%.
Аналогично диаграмме на рис. 3.1, зона вправо от пунктирной линии (кривой точек конденсации) также является областью чистого газа, в которой изотермы двух- и многокомпонентных систем аналогичны изотермам чистых компонентов.
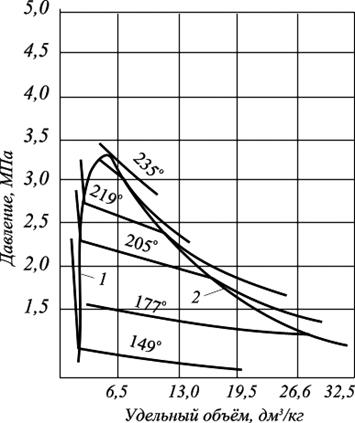
Рис. 3.3. Диаграмма фазового состояния смеси пентана и гептана
Влево от кривой точек парообразования изотермы жидкой фазы круто возрастают с уменьшением объема и они также аналогичны изотермам области жидкости чистых компонентов. В двухфазной же области двух- и многокомпонентных систем имеются значительные изменения. Было показано (рис. 3.1), что в области двухфазного состояния чистых углеводородов изотермы характеризуются горизонтальными линиями, т. е. давление не изменялось до полной конденсации газа. Для двух- и многокомпонентных систем, как это следует из рис. 3.3, давление в процессе сжатия в двухфазной области не остается постоянным и для конденсации газа необходимо повышать его для полного превращения газовой фазы в жидкость. Поэтому давление точки парообразования (кипения) для двух- и многокомпонентной смеси выше точек конденсации.
В соответствии с этим не одинаков и состав жидкой и газовой фаз в точках парообразования и конденсации. Вскоре после начала конденсации газа состав последнего еще близок к составу всей системы.
Точно так же вблизи точки парообразования состав жидкой фазы близок к составу исходной смеси. В двухфазной же области состав жидкой и газовой фаз отличен от состава исходной смеси и он непрерывно изменяется в соответствии с давлением и объемом системы.
Бинарные и многокомпонентные системы также имеют свои особенности и в области, лежащей вблизи критических давлений и температур. Критическая точка чистых веществ (или однокомпонентных систем) характеризуется самыми высокими давлениями и температурой, выше которых невозможно одновременно существование двух фаз – жидкой и газообразной. В бинарных и многокомпонентных системах критическая точка характеризуется лишь одинаково интенсивными свойствами газовых и жидких фаз. При этом в зоне пересечения кривых точек конденсации и парообразования образуется область, в которой могут существовать две фазы даже при температурах и давлениях, превышающих критические значения.
С появлением в системе второго компонента большие различия появляются также в диаграммах «давление — температура». Кривые точек начала кипения и точек росы не совпадают и образуют фазовую диаграмму, на вид которой, кроме температуры и давления влияет исходный состав смеси. Крайние левая и правая кривые на диаграмме (рис. 3.4) соответствуют давлениям насыщенного пара для чистых компонентов — этана и н-гептана с критическими точками С и С7.
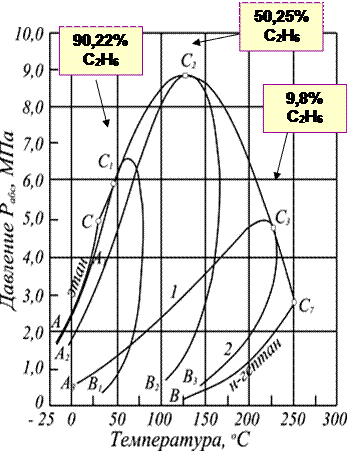
Рис. 3.4. Диаграмма фазового состояния смеси этана и н-гептана
Между ними расположены фазовые диаграммы смесей этана с н-гептаном с массовой концентрацией этана 90,22; 50,25 и 9,8% с соответствующими критическими точками С1, С2 и C3. Пунктирная линия представляет собой огибающую критических точек системы этан — н-гептан. Линии А1С1, А2С2 и А3С3 представляют собой линии точек начала кипения рассматриваемых смесей (выше и слева от них смесь находится в жидком состоянии), В1С1, В2С2 и В3С3 — линии точек росы соответствующих смесей. Ниже и справа от этих линий смесь находится в газообразном состоянии. Между линиями точек начала кипения и точек росы располагается двухфазная область. Из рис. 3.4 видно, что с увеличением содержания н-гептана в системе критическая точка, располагающаяся слева от максимальных значений давления и температуры, при которых две фазы могут существовать в равновесии, сдвигается вправо от нее. Кривые же точек росы и начала кипения при этом приближаются к кривой давления насыщенного пара, преобладающего в смеси компонента — н-гептана. Аналогично изменяются также критические температуры и давления при изменении состава смеси.
Величина критической температуры различных смесей находится между критическими температурами компонентов. По имеющимся экспериментальным данным для ее вычисления можно использовать свойство аддитивности (расчетные значения критических температур при этом получаются более близкими к действительным при выражении состава в процентах по массе, а не в молярных).
Критическое же давление смеси обычно выше, чем критическое давление чистых компонентов, кроме тех случаев, когда в смеси один из компонентов содержится в значительном количестве (т. е. правило аддитивности для вычисления ркр смеси нельзя применять). Отклонение фактической величины ркр от вычисленного критического давления по правилу аддитивности возрастает с увеличением разницы между молекулярными массами чистых компонентов. Наибольшее критическое давление обычно наблюдается у смеси с близким массовым содержанием обоих компонентов.
Как видно из рис. 3.4, размеры двухфазной области также зависят от состава смеси — они возрастают по мере того, как в составе смеси распределение между компонентами становится более равномерным.
Естественные углеводородные смеси отличаются большим разнообразием состава. Поэтому фазовые диаграммы нефтегазовых смесей, сохраняя принципиальные черты фазовых переходов двухкомпоненных систем, обладают еще своими в основном количественными особенностями, зависящими от состава нефти и газа.
Дата добавления: 2017-06-13; просмотров: 2098;











