ЭЛЕМЕНТЫ VА ГРУППЫ. ОБЩАЯ ХАРАКТЕРИСТИКА. Азот
Элементы и их символы: азот N, фосфор Р, мышьяк Аs, сурьма Sb, висмут Вi.
Степень окисления. Основные степени окисления элементов VА группы (+5), (+3) и (-3). Устойчивость состояний окисления (+5) и (-3) понижается, аустойчивость состояния окисления (+3) повышается с ростом порядкового номера элемента (от N к Bi). Таким образом, соединения висмута (III) более устойчивы, чем соединения висмута (V).
Свойства (табл. 1). Азот в свободном виде является неметаллом; у фосфора, мышьяка и сурьмы имеются металлические и неметаллические модификации, висмут – металл.
Гидроксиды элементов VА группы в высшей степени окисления отвечают гидроксидам с кислотными свойствами, сила кислот в водном растворе уменьшается от азотной кислоты к мышьяковой. В степени окисления (+3) элементы VА группы образуют слабые кислоты НNО2, H3РО3 и Н3АsО3 или амфотерные гидроксиды SbО(ОН) и Вi(ОН)3. По сравнению с соответствующими соединениями IVА группы данные гидроксиды более кислотные, а по сравнению с соединениями VIА группы – менее кислотные.
Устойчивость водородных соединений элементов VА группы уменьшается от азота к висмуту. При взаимодействии с кислотами аммиак NН3 образует соли аммония, а фосфин РН3 – соли фосфония. Атомы водорода в NН3, РН3, АsН3 и SbН3 могут замещаться на атомы активных металлов, такое замещение легче протекает у стибина SbН3. Продуктами этих реакций являются соответствующие нитриды, фосфиды, арсениды и стибиды.
Азот. Простое вещество и его строение. В свободном виде азот образует простое вещество, состоящее из двухатомных молекул N2. Строение молекулы N2: NºN.
Открытие. Азот впервые обнаружен и идентифицирован в 1772 г. (Шееле, Швеция, Д. Резерфорд, Шотландия).
Распространение в природе. В свободном виде азот является главной составной частью воздуха (78,1 % по объему). В связанном состоянии встречается в форме неорганических соединений, например селитры – натронной NаNО3 и калийной КNO3, а также аммиака (продукта гниения). В виде органических соединений азот содержится во всех организмах: белковые вещества (протеины и протеиды), нуклеиновые кислоты, конечные продукты обмена веществ – карбамид и мочевая кислота. Обнаружен азот в природных углях.
Биологическое значение. Азот – жизненно важный элемент, так как входит в состав белков и нуклеиновых кислот. Непосредственно из воздуха азот усваивают лишь некоторые бактерии, а все другие организмы способны усваивать только соединения азота. Растения извлекают азот из почвы с неорганическими веществами – нитратами и солями аммония; животные усваивают органически связанный азот при потреблении животной или растительной пищи. При гниении организмов из белковых веществ образуется, главным образом, аммиак. Конечным продуктом метаболизма азота у высших организмов является карбамид – мочевая кислота.
.
Таблица 1.
Свойства элементов VА группы
| Азот N | Фосфор P | Мышьяк As | Сурьма Sb | Висмут Bi | |
| Порядковый номер элемента | |||||
| Относительная атомная масса | 14,007 | 30,974 | 74,922 | 121,75 | 208,98 |
| Содержание в земной коре, % | 3*10-2 | 9*10-2 | 5,5*10-4 | 6,5*10-5 | 2*10-5 |
| Температура плавления, °С | -210 | 44,1 (белый) | |||
| Температура кипения, °С | -196 | 280 (белый) | |||
| Плотность при 20 °С, г/см3 | 0,96 | 1,82 | 5,72 | 6,68 | 9,80 |
| Степень окисления | |||||
| Степень окисления | |||||
| +5 | ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ возрастание устойчивости ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ | ||||
| +3 | ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ возрастание устойчивости ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® | ||||
| -3 | ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ возрастание устойчивости ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ | ||||
| Металлический характер | Неметалл ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®Металл | ||||
| Гидроксиды | HNO3 | H3PO4 | H3AsO4 | ¾ | ¾ |
| Сильная кислота | Слабые кислоты | ||||
| HNO2 | H3PO3 | H3AsO3 | SbO(OH) | Bi(OH)3 | |
| Слабые кислоты | Амфотерные гидроксиды | ||||
| Водородные соединения | NH3 | PH3 | AsH3 | SbH3 | ¾ |
| Аммиак | Фосфин | арсин | стибин |
Получение.
1. Разложение при нагревании твердого нитрита аммония, дает химически чистый азот:
NН4NО2 = N2 + 2Н2О
2. Физический метод — фракционная конденсация и дистилляция воздуха при низких температурах.
3. Химический метод — удаление из воздуха кислорода путем связывания его раскаленным коксом, порошком меди или железа, либо пропускание воздуха через щелочной раствор пирогаллола.
По второму и третьему методам получается «воздушный» азот, содержащий благородные газы.
Свойства. Бесцветный газ без вкуса и запаха. В отличие от жидкого кислорода азот в сжиженном состоянии бесцветен. Весьма химически инертен. При комнатной температуре реагирует только с литием, а при повышенных температурах — и с другими металлами, такими как Са и Мg, образуя соответствующие нитриды, например: 6Li + N2 ¾20°C® 2Li3N.
Применение. Газообразный азот хранят в стальном баллоне под давлением 150 атм. Его используют как газ, создающий инертную атмосферу для хранения и перевозки чувствительных к воздуху и влаге огнеопасных продуктов, при формовании полиамидных волокон и т. д.
2. Аммиак
Распространение в природе. Аммиак NН3 – это главный продукт естественного гниения органических веществ.
Получение.
1. Вытеснение аммиака из аммониевых солей при нагревании с щелочами:
NH4С1 + КОН = КС1 + Н2О + NH3, или нагревание водных растворов аммиака с последующим осушением газа натронной известью (твердая смесь NаОН + СаО). Способ используется в лабораторных условиях.
2. Выделение аммиака из продукта коксования углей — аммиачной воды. Этим способом получают аммиак в небольших количествах в промышленности.
3. Синтез из азота и водорода (реакция Габера – Боша): N2 + 3Н2 = 2NН3.
Это основной современный способ многотоннажного производства аммиака.
Производство синтетического аммиака (только для хим)
Синтез аммиака — многостадийное производство, включающее процессы получения технологической азотоводородной смеси, реакцию синтеза аммиака и его выделение. Азото-водородную смесь производят на основе синтез-газа.
1. Производство синтез-газа. Синтез-газ представляет собой смесь, состоящую в основном из СО и Н2 с примесью других газов. Сырьем для его получения служит твердое, жидкое или газообразное топливо.
Твердое сырье (буроугольный и каменноугольный кокс, сухой бурый уголь) подвергают твердой газификации водяным паром, кислородом и воздухом в газогенераторах. Полученную смесь N2, Н2 и СО с примесью СО2 очищают от серы, затем подвергают конверсии, очистке от СО2 и тонкой очистке.
Жидкое сырье (мазут, тяжелый остаток от прямой перегонки нефти) перерабатывают методом гидравлической газификации. В головке стального цилиндра распыляется жидкое топливо, реагирующее в пламенной зоне при 3 – 6 МПа (30 – 60 атм) и 1200 – 1600°С с кислородом и водяным паром. Продукты (в основном СО и Н2) проходят сажеуловитель и специальный реактор, где удаляется примесь оксида-сульфида углерода СОS в результате протекания реакции его с водяным паром: СОS + H2O = CO2 + H2S, затем подвергаются полной очистке от серы (десульфурация), конверсии и тонкой очистке. Полученный газ смешивают с N2.
Газообразное и легколетучее сырье (природный газ, метан, сжиженный газ, газы нефтеперегонки, бензин) перерабатывают методом парового риформинга. Очищенное от серы исходное сырье – газ или жидкость – поступает в реактор, нагреваемый путем сжигания природного газа или мазута; при »30 атм протекает каталитическая эндотермическая реакция с водяным паром: СН4 + Н2O « СО + 3Н2 или в общем виде: CnH2n+2 + nH2O « nCO + (2n+1)H2.
В полученную смесь вводят N2, подвергают ее конверсии, отмывке от СО2 и тонкой очистке.
2. Десульфурация (очистка от серы). Процесс основан на переводе органических соединений серы и СОS в Н2S. Это достигается двумя методами.
При мокрой десульфурации смесь газов пропускают через жидкость, которая поглощает Н2S (а при нагревании снова его выделяет). В качестве таких поглотительных жидкостей обычно применяют растворы аминосоединений, например саркозината натрия СН3—NН— СH2— СООNа, реже — глубокоохлаждеиный метанол.
При сухой десульфурации сероводород переводится в твердую серу при действии кислорода с использованием катализатора — активного угля или в твердый сульфид с помощью оксида цинка: 2H2S + O2 = 2H2O + 2S, ZnО + 2Н2S = ZnS + Н2О.
Второй способ более эффективен
3. Конверсия. С помощью каталитической реакции при участии водяного пара из синтез-газа получают дополнительное количество водорода: СО + Н2О = СО2 + Н2.
При этом трудноудаляемый СО превращается в легкоотделяемый СО2. Процесс ведут при 350 – 400°С и заканчивают при 200 – 250 °С, чем достигается почти полная конверсия СО. Для проведения этого процесса требуется хорошая предварительная очистка газового сырья.
4. Удаление диоксида углерода. Газообразный СО2 удаляют (вымывают), пропуская газовую смесь противотоком через воду, но чаще СО2 поглощают раствором карбоната калия при 30 атм: К2СО3 + СO2 + Н2O=2КНСО3.
5. Тонкая очистка. На этой стадии осуществляют каталитическое превращение таких контактных ядов, как монооксид углерода (его в газовой смеси остается еще 0,2 – 0,5%) в инертный, не участвующий в синтезе аммиака газ – метан, процесс ведут при 30 атм и 100 – 150°С:
СО + 3Н2 = СН4 + Н2О. Образующуюся воду удаляют вымораживанием.
6. Введение азота. В приготовленный по указанным выше стадиям газ вводят до получения азото-водородной смеси с мольным отношением Мг : Нг — 1 : 3.
7. Синтез аммиака. Азото-водородная смесь вводится в трубчатый реактор высотой 60 м, изготовленный из стали, стойкой по отношению к водороду под давлением. В реакторе имеется много слоев катализатора (FеО + Fе2О3 + К2О + Аl2О3). Процесс осуществляется при 250 – 350 атм) и 450 °С 550 °С. Температура разогревающейся реакционной смеси поддерживается на оптимальном уровне путем ввода холодных порций азото-водородной смеси.
8. Выделение аммиака. Полученную смесь газов (15 % NH3, 85 % N2 + Н2) охлаждают до -10 °С, при этих условиях аммиак сжижается. Иногда вместо стадии сжижения смесь газов пропускают через воду для поглощения аммиака. Остаток (смесь N2 и Н2) возвращается в реактор синтеза аммиака. После многократного циркулиро-вания из остаточной смеси выделяют также аргон, используемый для специальной электросварки.
Свойства. Бесцветный газ со стойким характерным (аммиачным) запахом, т. пл. - 77,8 °С; т. кип. - 33,4 °С. Аммиак значительно легче воздуха. Сжижается при 20 °С под давлением 8,5 атм. Загорается аммиак только в атмосфере чистого кислорода или при вдувании его в пламя другого горящего газа. Смеси с воздухом в интервале от 15,5 до 27,5 % (об.} NН3 взрывоопасны.
Очень хорошо растворим в воде с образованием гидрата аммиака. При взаимодействии с кислотами дает соли аммония: NH3 + НС1 = NН4С1.
Известны амминокомплексы с ионами многих металлов, например сульфат тетраамминмеди (II) [Сu(NН3)4]SО4.
Жидкий аммиак может выполнять роль неводного растворителя, в этом растворителе соли аммония обладают функцией кислоты, а амиды — функцией основания. Реакция нейтрализации в жидко-аммиачной среде описывается уравнением: NH4+ + NH2- = 2Nн3.
Щелочные и щелочноземельные металлы химически растворяются в жидком аммиаке.
Обнаружение. посинение влажной красной лакмусовой бумажки; образование «дыма» NН4С1 при поднесении концентрированного раствора НСl на стеклянной палочке к отверстию сосуда с NН3; выпадение коричневого хлопьевидного осадка при введении аммиака в реактив Несслера — щелочной раствор тетраиодомеркурата (II) калия К2[НgI4].
Применение. Аммиак — важнейшее сырье для производства различных химических продуктов, например азотной кислоты и ее производных, в том числе удобрений, взрывчатых веществ, красителей, солей аммония, карбамида, циановодорода, акрилонитрила, аминов (метиламина и др.) и амидов (формамид, диметилформамид и др.), соды. Используется также как хладоагент в холодильных машинах, для проявления светокопировальной бумаги. Жидкий аммиак — промышленный неводный растворитель.
3. СОЕДИНЕНИЯ АММОНИЯ
Катион аммония NН4+ (бесцветный) образует соли аммония, которые сильно напоминают соли калия. Соли аммония легко разлагаются при нагревании с выделением газообразного аммиака: (NН4)3РО4 = 3NH3 + Н3РО4.
Аммиак выделяется и при обработке солей аммония горячим раствором щелочи:
3NаОН + (NН4)3РО4 = Nа3РО4 + 3NН3 + 3Н2О.
Все распространенные соли аммония хорошо растворяются в воде.
Аммоний в свободном виде NН4 известен только в виде сплава со ртутью (амальгама аммония). Аммоний образуется из амальгамы натрия в солей аммония, но при комнатной температуре легко разлагается на аммиак и водород уже за несколько минут.
Водный аммиак (аммиачная вода, нашатырный спирт) образуется при растворении аммиака в воде. Растворение сопровождается образованием гидрата аммиака NН3*Н2О (ранее называвшегося гидроксидом аммония NН4ОH). Гидрат аммиака проявляет в водном растворе слабые основные свойства. Таким образом, при растворении аммиака в воде осуществляются следующие равновесия: NН3 + Н2O « NН3*Н2О « МН4+ + ОН-.
В 1М водном аммиаке при 18 °С содержится только 0,4% ионов NН4+ и ОН-, т. е. 1М раствор NН3*Н2О — очень разбавленный раствор NН4ОН (это означает, что ионное соединение NН4ОН в чистом виде не существует). При добавлении кислоты к раствору гидрата аммиака образуются соответствующие соли аммония: 2(NН3•Н2О) + Н2SО4 = (NН4)2SО4 + 2Н2О.
Водный аммиак применяют для нейтрализации кислот, для производства удобрений, как жидкая среда специальных составов по чистке медных изделий.
Хлорид аммония (нашатырь) NН4С1 получают из аммиака и хлороводорода или из концентрированного раствора аммиака и хлороводородной кислоты. Разлагается при нагревании (термическая диссоциация) на аммиак и хлороводород, но при охлаждении смеси NН3 и НС1 снова кристаллизуется NН4С1. Применяют как флюс для пайки (превращает поверхностные оксиды металлов в летучие хлориды и тем самым способствует спаиванию металлов), при изготовлении сухих гальванических элементов, например элемента Лекланше, в производстве минеральных удобрений, в медицине в качестве слизерастворяющего средства.
Сульфат аммония (NН4)2S04 производят в больших количествах, его применяют в минеральных удобрениях, при выработке дрожжей и для огнезащитной пропитки бумаги. Промышленное получение сульфата аммония основано на барботировании диоксида углерода через водоаммиачную смесь гипса СаSО4*2Н2О или ангидрита СаSО4; процесс складывается из реакций: 2NН3 + СО2 + Н2О = (NН4)2СО3, (NH4)2СО3 + СаSО4 = (NН4)2SО4 + СаСО3
Оседающий карбонат кальция отфильтровывают, а раствор сульфата аммония выпаривают.
Нитрат аммония (аммонийная селитра) NН4NО3 получают из аммиака и азотной кислоты. При нагревании дает оксид диазота N20, известный под названием «веселящий газ». Применяют как компонент удобрений и взрывчатых веществ, например донарита, имеющего состав 55 % NН4NО3, 22 % нитроглицерина, 10 % тринитротолуола, 10 % NaNО3, 1 % коллоксилина (динитрата целлюлозы), остальное — древесная мука и Fе2O3.
Гидрокарбонат аммония NН4НСО3 получают из смеси NН3 + СО2 + Н2О. Техническая соль всегда содержит примесь карбамината аммония NН2СООNН4. При нагревании легко разлагается на исходные продукты его производства, поэтому гидрокарбонат аммония необходимо хранить в закрытом сосуде. Применяют как химический разрыхлитель теста.
4. ОКСИДЫ АЗОТА
В оксидах азот имеет степени окисления от (+1) до (+5). Только оксиды N2О3 и N2О5 можно считать кислотными, иногда NО2 и N2О4 рассматриваются как оксиды, двух кислот сразу. Известные нитрозные газы состоят из NO, NO2 и N2О4.
Оксид азота (IV) (веселящий газ) N2O— бесцветный газ с приятным, слегка сладковатым запахом, т. кип. -88,5°С. Умеренно растворим в воде. Образуется при нагревании нитрата аммония: NН4NО3 = N2О + 2Н2О.
При вдыхании оксида азота (IV) в первый момент он вызывает у человека возбуждение, а затем оказывает усыпляющее действие. В смеси с кислородом используется в медицине как наркотическое средство.
оксид азота (II) NO — бесцветный газ, который на воздухе постепенно приобретает коричнево-бурую окраску (вследствие протекания реакции 2NО + О2 = 2NО2). Т. кип. -152°С. Практически не растворим в воде. Получают при взаимодействии разбавленной азотной кислоты со многими металлами, например с медью; образуется при электрическом разряде в грозовой атмосфере (молния). Монооксид азота является промежуточным продуктом технического синтеза азотной кислоты.
оксид азота (III) N2О3 — при низких температурах темно-синяя жидкость, разлагающаяся при температуре выше 0°С на смесь NO и NО2. Кислотный оксид при взаимодействии с водой на холоду образует азотистую кислоту НNО2. С щелочами в водном растворе дает соответствующие нитриты.
Диоксид азота NО2 — красно-коричневый (бурый) газ со своеобразным запахом. Конденсируется при 21,2°С и затвердевает при -10,2°С (жидкость и кристаллы бесцветны). Очень ядовит. При длительном воздействии NО2 появляются признаки тяжелого отравления, главным образом отек легких.
При взаимодействии диоксида азота с щелочами образуется смесь нитритов и нитратов:
2NО2 + 2КОН = КNО2 + КNO3 + Н2О.
Диоксид азота входит в состав «нитрозных газов» — газовой смеси, выделяющейся при взаимодействии азотной кислоты (при ее разной концентрации в растворе) с металлами, при термическом разложении азотной кислоты и нитратов тяжелых металлов, при взаимодействии нитритов с сильными кислотами а также при автогенной сварке или при блестящем травлении медных и латунных изделий.
Мономерная форма диоксида азота (NО2) всегда находится в равновесии с его бесцветным (в газообразном и жидком состояниях) димером — тетраоксидом диазота N2О4: 2NО2 « N2О4.
При 64°С примерно половина N2О4 находится в виде NО2, при более высоких температурах содержание NO2 еще более увеличивается.
оксид азота (V) N2О5 — бесцветные взрывчатые кристаллы. Получают при обезвоживании азотной кислоты на холоду с помощью Р4O10: 4НNО3 + Р4O10 = 2N2О5 + 4НРО3.
N2O5 — кислотный оксид, бурно реагирует с водой, образуя азотную кислоту НNО3.
5. АЗОТНАЯ КИСЛОТА И НИТРАТЫ
Азотная кислота
Формула: НNО3 в водном растворе полностью переходит в ионы Н3О+ и NО3-.
Получение.
1. Каталитическое окисление аммиака (способ Оствальда, используемый в промышленности с 1915 г.). В основе способа лежат следующие реакции:
4NH3 + 5O2 = 4NO + 6Н2O (1), 2NO + O2 (2), 4NО2 + О2 + 2Н2О = 4НNО3 (3).
Смесь аммиака с воздухом очень быстро пропускают через катализатор — нагретую сетку из платины и родия (2000 отверстий на 1 см2); продолжительность контакта реакционной смеси с катализатором 0,0002 с.
2. Нагревание нитрата натрия с азотной кислотой: 2NаNO3 + Н2SO4 = Nа2SО4 + 2НNО3.
Старый промышленный способ, в качестве сырья используется натронная селитра.
Свойства. Безводная (100 %) азотная кислота представляет собой бесцветную сильно пахнущую жидкость, т. кип. 86°С. При хранении на свету кислота постепенно окрашивается в красно-коричневый (бурый) цвет вследствие разложения с образованием высших оксидов азота (в том числе окрашенного гЮ2). Выпускаемая промышленностью (60 – 68 %) кислота кипит при 122°С (азеотропная смесь с водой).
Концентрированная азотная кислота, содержащая значительные количества молекул НNО3, действует как сильный окислитель, но по мере разбавления ее водой, образующейся при реакции, окислительная активность кислоты снижается. Продуктом восстановления азотной кислоты являются нитрозные газы. В концентрированной азотной кислоте легко окисляются солома, древесина, фосфор и многие металлы, в том числе такие как медь, ртуть и серебро, например:
Сu + 4НNО3(конц.) = Сu(NО3)2 + 2NО2 + 2Н2О, 3Сu + 8НNО3(разб.) = 3Сu(NО3)2 + 2NO + 4Н2О.
Азотная кислота не взаимодействует с золотом и платиной, которые могут быть переведены в раствор только при обработке царской водкой — смесью концентрированных растворов НС1 и НNО3 в объемном отношении 3 : 1. Некоторые металлы не реагируют с азотной кислотой из-за их пассивирования — образования устойчивой оксидной пленки. Так, алюминий и железо устойчивы к действию холодного раствора НNО3, а хром — также к действию горячего раствора кислоты. В сильно разбавленной азотной кислоте уже нет молекул (существуют только ионы Н3О и NO3-), поэтому такая НNО3 уже не переводит в раствор медь и другие благородные металлы.
Концентрированная азотная кислота действует на углеводороды, особенно ароматические, и образует либо нитросоединения (содержат нитрогруппу —NО2), либо сложные эфиры — нитраты (содержат нитратную группу —ОNO2), Обычно для нитрования углеводородов используется нитрующая смесь — концентрированные НNО3 и Н2SO4. Окрашивание белковых тел, в частности кожи, в желтый цвет при их контакте с концентрированной азотной кислотой — ксантопротеиновая реакция также является процессом нитрования.
Обнаружение.
1. При нейтрализации азотной кислотой органического основания — нитрона выпадает белый осадок.
2. Раствор, содержащий ионы NО3-, и Fе2+, наливают на слой концентрированной Н2SО4, в месте соприкосновения жидкостей образуется бурое кольцо, указывающее на образование комплекса [Fе(NО) (Н2О)5]2+ — катиона пентаакванитрозилийжелеза (I).
Применение. Азотная кислота — один из основных продуктов многотоннажной химической промышленности. Приблизительно 75 % НNО3, получаемой в промышленности, используется для производства удобрений, 15 % — для производства взрывчатых веществ и 10% —для других целей. Основные химические продукты, производимые с использованием азотной кислоты, пути их получения и области применения показаны на схеме.
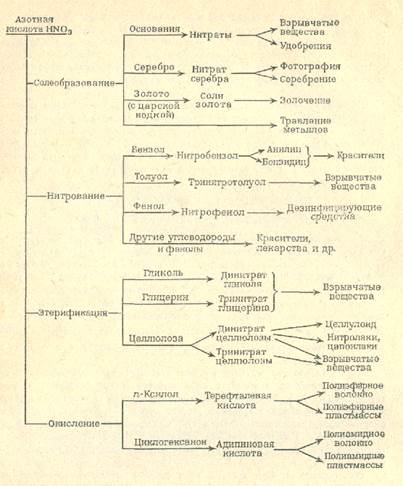
Нитраты
Соли и эфиры азотной кислоты называются нитратами. Тривиальные названия некоторых нитратов: KNO3 – калийная (индийская) селитра; NaNO3 – натронная (чилийская) селитра; NH4NO3 – аммонийная селитра; NH4NO3 – аммонийная селитра; Ca(NO3)2 – известковая норвежская селитра; Ba(NO3)2 – баритовая селитра; AgNO3 – адский камень (ляпис).
Нитраты всех металлов хорошо растворимы в воде. При нагревании нитраты разлагаются, продукты разложения зависят от природы нитрата.
а) нитраты щелочных металлов дают нитрит и кислород: 2КNО3 = 2КNO2 + О2
б) нитраты остальных металлов дают оксид металла (или металл в свободном виде, если оксид термически неустойчив), диоксид азота и кислород:
2Рb(NО3)2 = 2РbO + 4NО2 + О2; 2АgNО3 = 2Аg + 2NО2 + О2
5 (6). ДРУГИЕ СОЕДИНЕНИЯ АЗОТА
Азотистая кислота НNО2 устойчива только в разбавленном водном растворе, при его концентрировании НNО2 распадается на Н2О, NO и NО2. Соли азотистой кислоты нитриты — ядовиты. Хорошо растворимы в воде. При взаимодействии с сильными кислотами образуют бурые нитрозные газы, например: 2NаNO2 + Н2SО4 = Nа2SO4 + Н2О + NO + NО2.
Азидоводород НN3 (строение молекулы Н—N = N º N) – бесцветная жидкость с резким запахом, ядовитая и взрывоопасная, т. кип. 35,7°С. Растворим в воде, раствор проявляет слабые кислотные свойства, поэтому водный раствор называется азидоводородной кислотой. Соли — азиды, например азид свинца (II) Рb(N3)2, который используется как детонатор взрывчатых веществ.
Гидразин N2Н4(Н2N—NН2) – бесцветная жидкость. В водном растворе образует гидрат гидразина N2Н4*Н2О, имеющий свойства слабого основания. Подобно аммиаку, гидразин при обработке кислотами образует соли гидразиния, например N2Н5Сl — хлорид гидразиния (1+), N2Н6SO4— сульфат гидразиния (2+). Сам гидразин и его метилпроизводные, особенно N, N-диметилгидразин Н2N—N(СН3)2 применяются в качестве эффективных ракетных топлив.
Гидроксиламин NН2ОН — бесцветные гигроскопичные кристаллы в форме пластинок. При нагревании взрывается. Более устойчивы, чем сам гидроксиламин, соли гидроксиламмония, например хлорид гидроксиламмония (NН3ОН)С1.
Нитрид трихлора С13N — темно-желтое, весьма взрывчатое, маслообразное вещество. Нитрид трииода известен только в виде сольвата I3N * nNН3, выпадает в виде серо-черного осадка при смешивании йода и концентрированного раствора аммиака. в сухом состоянии сольват взрывается от малейшего прикосновения.
Цианамид кальция СаСN2 — производное цианамида NН2СN.
В промышленности получают по реакции карбида кальция с азотом при 900°С:
СаС2 + N2 = СаСN2 + С
Представляет собой серый порошок со слабым запахом аммиака и ацетилена. Смесь СаСN2 +С применяется в качестве гербицида и минерального удобрения, а также для получения дициандиамида НN = С(NН2)—МН—СN, который, в свою очередь, является сырьем для производства аминопластов и древесных клеев.
Азотные удобрения. Содержат азот в качестве основного питательного элемента. Основные виды азотных удобрений: жидкий аммиак NН3, смесь сульфата аммония с аммонийной селитрой (NН4)2SО4 + NН4NО3, карбамид СО(NН2)2, сульфат аммония (NН4)2SО4.
7. ФОСФОР
Открытие. Фосфор Р открыт в 1669 г. (Бранд, Германия) в результате алхимических поисков философского камня (в частности, обнаружен в остатках мочи после ее выпаривания).
Распространение в природе. Встречается только в химически связанном виде в организмах и минералах. В живых организмах фосфор содержится в форме фосфолипидов (например, лецитин в нервном и мозговом веществе), фосфопротеидов (ферменты), различных эфиров ортофосфориой кислоты и ортофосфата кальция (в костях и зубах). Экскременты птиц образуют природное фосфорсодержащее вещество — гуано.
Минералы: фосфорит 3Са3(РО4)2*Са(ОН)2, апатит 3Са3(РО4)2*Са(С1, ОН, F)2, монацит СеРО4. Фосфаты содержатся также в некоторых рудах железа.
Физиологическое действие. Фосфор — жизненно важный элемент для всех организмов.
Свойства (см. также табл. 1).
Таблица 1.
Свойства аллотропных модификаций фосфора
| Белый фосфор | Красный фосфор | Черный фосфор | ||
| Окраска | Белая | Красно-фиолетовая | Серо-черная | |
| Запах | Чесночный | Не имеет | Не имеет | |
| По степени твердости | Высокообразный | Твердый | Относит. мягкий | |
| Характер модификации | Неметаллические | Металлический | ||
| Температура плавления °С | Только при высоком давлении | |||
| Плотность при 20°С, г/см3 | 1,82 | 2,36 | 2,70 | |
| Растворимость | Мало в Н2О, хор. в CS2 | Нерастворимые | ||
| Реакционная способность | Высокая | Низкая | Средняя | |
| Люминесценция | Есть | Нет | Нет | |
Известно несколько аллотропных модификаций фосфора, среди которых наиболее распространенные белый, красный и черный фосфор. Их свойства представлены в табл. 1.
Между модификациями фосфора осуществляются следующие переходы:
а) белый фосфор ® красный фосфор, процесс протекает медленно при комнатной температуре, ускоряется при нагревании в закрытом сосуде при 330°С.
б) красный фосфор ® белый фосфор, выше 280°С красный фосфор перегоняется при нормальном атмосферном давлении и конденсируется в виде белого фосфора;
в) белый фосфор ® черный фосфор; переход протекает при ударном прессовании под давлением 10000 МПа или при нормальном атмосферном давлении и 380°С на катализаторе (мелкодисперсная ртуть).
Белый фосфор получают из фосфата кальция Са3(РО4)2 (фосфорита) при нагревании с песком (SiO2) и коксом (С): Са3(РО4)2 + 3SiO2 + 5С = 3СаSiO3 + 2Р + 5СО.
Газообразную смесь (фосфор и оксид углерода (II)) пропускают через воду, при этом белый фосфор конденсируется.
Белый фосфор состоит из молекул Р4. В темноте на воздухе он обнаруживает зеленоватое свечение (люминесценция), сопровождающееся выделением теплоты. это явление обусловлено медленным окислением до Р4O6, причем выделяющаяся теплота может расплавить фосфор и привести к его воспламенению (поэтому белый фосфор хранят под водой). При горении фосфора образуется белый дым — мелкие частички Р4О10. Горящий фосфор нельзя гасить водой, его следует засыпать песком.
В растворе щелочи диспропорционирует, образуя соединения фосфора (+1) и фосфора(-3):
Р4 + 3КОН + 3Н2О = 3К(РН2О2) + РН3
Белый фосфор применяют для получения других его аллотропных модификаций, фосфорных кислот и фосфатов, как боевое зажигательное вещество.
Белый фосфор чрезвычайно ядовит, смертельная доза составляет 50 — 500 мг, он может попадать в организм через органы дыхания и пищеварения, всасывается через кожу (в местах ее повреждения). Хроническое отравление фосфором проявляется в поражении костей и исхудании.
Красный фосфор более устойчив и менее реакционноспособен, чем белый фосфор. Красный фосфор не ядовит, однако поступающие в продажу образцы часто содержат ощутимые количества белого фосфора, что следует учитывать при работе с товарными образцами фосфора. Применяют при изготовлении спичек и как наполнитель (пары) в лампах накаливания.
Рабочая поверхность (намазка) спичечного коробка содержит смесь красного фосфора, сульфида сурьмы (III) Sb2S3 и стекольного порошка, которая закреплена на связующем — декстриновом клее, в состав спичечной головки входят хлорат калия КСlO3, сера и др. При быстром проведении головкой спички по рабочей поверхности коробка хлорат калия окисляет фосфор, что сопровождается воспламенением серы, а затем и древесной основы спички. В состав головки универсальных (ветровых, охотничьих) спичек входит Р4S3, такие спички не гаснут на ветру.
Черный фосфор имеет, как и графит, слоистую решетку, проводит электрический ток. Не ядовит.
8. ФОСФОРНЫЕ КИСЛОТЫ И ФОСФАТЫ
Оксид фосфора (V) Р2О5 (точнее, Р4О10) — кислотный оксид, которому соответствуют фосфорные кислоты. Белое гигроскопичное порошкообразное (при полном отсутствии влаги) вещество. Возгоняется при 359°С. Взаимодействует с водой с образованием фосфорных кислот. Применяют в качестве эффективного водопоглощающего средства (в эксикаторах и т. п.).
В зависимости от количества воды, реагирующей с оксидом фосфора, образуются следующие фосфорные кислоты:
метафосфорная кислота Р4О10 + 2Н2О = 4НРО3 [точнее, (НРО3)n]
дифосфорная кислота (пирофосфорная кислота) Р4О10 + 4Н2О = 2Н4Р2О7
ортофосфсрная кислота (или просто фосфорная кислота) Р4О10 + 6Н2O = 4Н3РО4
Известны соли всех этих кислот: мета-, ди- и ортофосфаты (часто просто фосфаты).
Ортофосфорная кислота Н3РО4 — бесцветные кристаллы, с небольшим количеством воды образует сиропообразный, неядовитый раствор с сильным кислым вкусом.
Способ обнаружения ортофосфорной кислоты заключается в добавлении раствора кислоты (или ортофосфата какого-либо металла) в сильно подкисленный азотной кислотой раствор молибдата аммония при нагревании — выпадает желтый порошкообразный осадок молибдофосфата аммония.
Ортофосфорную кислоту применяют для получения ортофосфатов, для фосфатирования железа и цинка, в приготовлении электролитических и химических полировальных смесей для металлов (вместе с серной и хромовой кислотами), в технологии безалкогольных напитков, для производства катализаторов и лекарственных средств.
Ортофосфаты образуются при ступенчатой нейтрализации ортофосфорной кислоты. Поскольку эта кислота трехосновная, она образует три ряда солей: средние и два типа кислых солей, например;
NаН2РО4 — дигидроортофосфат натрия, Nа2НРО4 — гидроортофосфат натрия, Nа3РО4 — ортофосфат натрия, Са(Н2РО4)2 — дигидроортофосфат кальция (растворим в воде), СаНРО4 — гидроортофосфат кальция (не растворим в воде, растворяется в растворе лимонной кислоты), Са3(РО4)2 — ортофосфат кальция (не растворим в воде и в растворе лимонной кислоты)
Хорошо растворимы в воде следующие ортофосфаты:
средние ортофосфаты щелочных элементов (кроме лития, а также аммония); моногидроортофосфаты щелочных элементов; дигидроортофосфаты щелочных и некоторых (особенно двухвалентных) тяжелых металлов. Все остальные ортофосфаты в воде практически нерастворимы.
Применение ортофосфатов весьма разнообразно. Их используют как минеральные удобрения, в качестве умягчителей воды (Na3РO4) и огнестойкой пропитки [соль (NН4
Дата добавления: 2021-09-07; просмотров: 181;
<== предыдущая лекция
|
следующая лекция ==>
Задачи для самостоятельного решения. | Основные черты права Спарты










