Строение атомов и молекул
Мельчайшей частицей любого вещества является молекула, которая в свою очередь состоит из атомов. Основными элементарными частицами, из которых строятся все известные нам атомы, являются протоны, нейтроны и электроны. Протоны имеют положительный заряд, электроны – отрицательный. Заряды протона и электрона равны по величине и составляют 16×10-20К. Это элементарный, т.е. наименьший электрический заряд. Нейтроны, как говорит само название, являются нейтральными частицами, не имеющими заряда.
Согласно упрощенной модели Нильса Бора атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, компенсируя положительный заряд ядра. Ядро состоит из протонов и нейтронов. Электроны располагаются вокруг ядра несколькими слоями – оболочками на очень большом по сравнению со своими размерами расстоянии. Строение ядер атомов и периодичность заполнения оболочек электронами можно находить с помощью таблицы Д. И. Менделеева.
Атом имеет размеры порядка ангстрема (один ангстрем равен 10-10м). Молекулы различных веществ содержат различное число атомов. Например, гелий и аргон – одноатомные газы, водород и кислород – двухатомные, озон – трехатомный. В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Ионная связьобусловлена кулоновским притяжением противоположно заряженных ионов. Этот вид связи наиболее характерен для неорганических диэлектриков, имеющих в своем составе ионы противоположных знаков, например Na+-Cl-, Li+-F-.
Ковалентная (атомная)связь обусловлена образованием обобществленных (общих пар) валентных электронов по одному от каждого атома. Такая пара электронов устойчива в результате обменного взаимодействия при противоположной ориентации спиновых и соответствующих орбитальных магнитных моментов электронов. В отличие от ионной, ковалентная связь имеет направленный характер, она образуется в том направлении, в котором расположена наибольшая плотность объединенных электронов.
Металлическая связьобусловлена взаимодействием между положительно заряженными ионами металла, образовавшихся за счет потери (отрыва) электронов и этими коллективизированными электронами («электронным газом»). «Электронный газ» оказывает цементирующее действие на кристаллическую структуру металлов и обуславливает их высокую электропроводность, теплопроводность и пластичность.
Молекулярная связь (или силы Ван-дер-Ваальса)обусловлена электростатическим диполь-дипольным взаимодействием между молекулами, которое возникает в результате неоднородного распределения заряда электронов вокруг ядер.
Водородная связьосуществляется через ион водорода (протон), расположенный между двумя ионами (О, F, Cl) соседних молекул. Водородная связь реализуется в воде Н2О, некоторых органических соединениях и в кристаллах типа дигидрофосфата калия КН2РО4.
Энергия химических связей, к которым можно отнести ковалентную, ионную и металлическую связи, составляет ~102 кДж/моль. Энергия межмолекулярных взаимодействий существенно меньше. Энергия водородной связи ~10…50 кДж/моль, а энергия вандерваальсового межмолекулярного взаимодействия всего ~0,1…1 кДж/моль. Кроме того, в отличие от ионного или металлического типа связей, ковалентные связи имеют ярко выраженную направленность в сторону наибольшей плотности объединенных электронов. Поэтому материалы, полученные из веществ с различным типом связей, сильно отличаются по своим электрическим и другим свойствам.
Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются нейтральными. Если же в отдельных молекулах (рисунок 24) центры противоположных по знаку зарядов 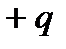 и
и 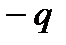 не совпадают и находятся на некотором расстоянии l друг от друга, то такие молекулы называются полярными или дипольными. Полярная молекула характеризуется величиной дипольного момента
не совпадают и находятся на некотором расстоянии l друг от друга, то такие молекулы называются полярными или дипольными. Полярная молекула характеризуется величиной дипольного момента 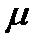 , который определяется произведением заряда
, который определяется произведением заряда 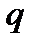 и расстояния
и расстояния 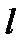 между центрами положительного и отрицательного зарядов:
между центрами положительного и отрицательного зарядов: 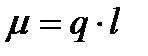 . Электрический момент полярной молекулы является векторной величиной. За направление вектора
. Электрический момент полярной молекулы является векторной величиной. За направление вектора 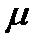 принимают направление от отрицательного заряда к положительному. При отсутствии внешнего электрического поля суммарный дипольный момент равен нулю, так как диполи расположены хаотично. При приложении внешнего электрического поля диполи и из электрические моменты ориентируются по направлению поля.
принимают направление от отрицательного заряда к положительному. При отсутствии внешнего электрического поля суммарный дипольный момент равен нулю, так как диполи расположены хаотично. При приложении внешнего электрического поля диполи и из электрические моменты ориентируются по направлению поля.
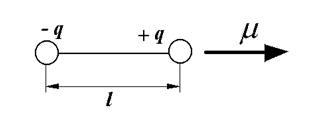
Рисунок 24. Схема строения полярной молекулы.
Нейтральный атом, получив некоторое количество энергии извне может лишиться части электронов, и превратиться в положительный ион и свободные электроны. Такой процесс носит название ионизации. Атом может и присоединять дополнительные электроны, превращаясь в отрицательный ион. Ионами могут быть и группы атомов, потерявших или присоединивших электроны.
Дата добавления: 2017-04-05; просмотров: 3652;











