Способы получение альдегидов.
Определение и классификация альдегидов.
Альдегиды – это органические кислородосодержащие соединения, в молекулах которых имеется одна или несколько альдегидных групп (–CHO), связанных с углеводородным радикалом.
O O
// //
R – C (R – CHO) CH3 – C (CH3 – CHO)
\ \
H H
Этаналь
Альдегиды – это органические соединения, производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на альдегидную группу (–CHO).
Классификации альдегидов (параллельные):
I. по углеводородному радикалу (R–):
· предельные (насыщенные) (CH3–CH2–)
· непредельные (ненасыщенные) (CH2= CH–, CH≡C – и т.д.)
· ароматические (C6H5 –).
II. по числу альдегидных групп:
· моноальдегиды, R–CHO
· диальдегиды, R – (CHO)2, OHC−R–CHO
· триальдегиды, R – (CHO)3 и т.д.
Номенклатура альдегидов.
По международной номенклатуре названия альдегидов производят по названию соответствующего углеводорода с добавлением суффикса -аль к названию углеводорода самой длинной углеродной цепи, включающей карбонильную группу, от которой начинают нумерацию цепи. Количество альдегидных групп указывают числом ди-, три- и т.д.
Тривиальные названия от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
Примеры:
CH3–CH2–CHO предельный моноальдегид – пропаналь (альдегид пропановой кислота),
CH2=CH–CHO непредельный моноальдегид – пропеналь (альдегид пропеновой кислота),
OHC–CH2–CH2–CHO предельный диальдегид – бутандиаль (альдегид глутаровой или бутандиоловой кислота),
C6H5–CHO ароматический моноальдегид – бензальдегид (альдегид бензойной кислоты).
| Формула | Название | |
| систематическое | тривиальное | |
| H2C=O | метаналь | муравьиный альдегид (формальдегид) |
| CH3CH=O | этаналь | уксусный альдегид (ацетальдегид) |
| CH3CH2CH=O | пропаналь | пропиновый альдегид |
| CH3CH2CH2CH=O | бутаналь | масляный альдегид |
| (CH3)2CHCH=O | 2-метил-пропаналь | изомасляный альдегид |
| CH3CH2CH2CH2CH=O | пентаналь | валериановый альдегид |
| CH3CH=CHCH=O | бутен-2-аль | кротоновый альдегид |
Изомерия альдегид.
- Изомерия углеродного скелета, начиная с C4
γ β α O γ β α O
4 3 2 1// 4 3 2 1//
CH3–CH–CH2–C CH3–CH2–CH–C
| \ | \
CH3 H CH3 H
3-метилбутаналь 2-метилбутаналь
(β-метилбутановая кислота, (α-метилбутаналь)
- Изомерия положения
а. положения кратной связи (для непредельных альдегид)
4 3 2 1 4 3 2 1
CH2= CH – CH2 – CHO CH3 –CH= CH – CHO
бутен-3аль бутен-2аль
б. положения заместителей
3 2 1 3 2 1
CH2 – CH2 – CHO CH3 – CH – CHO
| |
Cl Cl
3-хлорпропаналь 2-хлорпропаналь
- Пространственная изомерия (для непредельных альдегидов)
CH3–CH=CH–CHO
H3C CHO H CHO
\ / \ /
C = C C = C
/ \ / \
H H H3C H
цис-бутен-2аль транс-бутен-2аль
- Межклассовая изомерия:
а) с кетонами и непредельными спиртами и непредельными простыми эфирами, начиная с C3
O O
4 3 2 1// 3 2 1//
CH3–CH2–CH2–C CH3–CH2–C
\ \
H CH3
бутаналь метилэтилкетон
4 3 2 1
CH3–CH=CH–CH2−OH CH3– CH2– O– CH =CH2
бутен−2ол этилвиниловый эфир
б) с циклическими оксидами (начиная с С2)
O H2C ─ CH2
// \ /
CH3–C O
\
H этиленоксид
этаналь (эпоксид)
4. Строение карбонильной группы
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы.
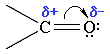
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации образует одну π-связи и три σ- связи (одна из них – связь С–О). σ- связи расположены в одной плоскости под углом 120° друг к другу.
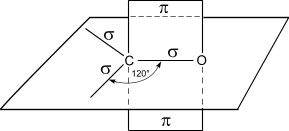
Схема строения карбонильной группы
Связь С=О сильно полярна. Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд
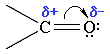
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород электрофильными, в том числе Н+. Важнейшими реакциями альдегидов являются реакции нуклеофильного присоединения по двойной связи карбонильной группы.
В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей.
5. Физические свойства альдегидов.
Метаналь (формальдегид) – газ, альдегиды С2-C5 – жидкости, высшие альдегиды – твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов. В ряду
алканы → альдегиды (кетоны) → спирты
растворимость в воде и температура кипения увеличивается.
Физические свойства некоторых альдегидов.
Формальдегид HCH=O– газ, с характерным резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему, ядовит. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! 40 %-ный водный раствор формальдегида – формалин (с увеличением температуры растворимость уменьшается). Применяется в медицине для дезинфекции, получения пластмасс.
Ацетальдегид CH3CH=O– бесцветная легкокипящая жидкость, растворимая в воде, ядовита, с запахом зелёной листвы. ОЧЕНЬ ТОКСИЧЕН! Подавляет дыхательные процессы в клетках. Применяется для получения пластмасс, этанола, уксусной кислоты.
Акролеин СН2=CHCH=O (акриловый альдегид, пропеналь) – жидкость с неприятным запахом, раздражает слизистые ткани, образуется при пригорании жиров. Применяется в производстве полимеров.
Бензальдегид C6H5CH=O – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.Применяется в производстве красителей.
Способы получение альдегидов.
1. Окисление первичных спиртов:
а) кислородом окислителя (K2Cr2O7 или KMnO4 в кислой среде)
CH3−OH + CuO → HCH=O + Cu + H2O,
б) кислородом воздуха
CH4 + O2  HCH=O + H2O (при 500oС в присутствии оксидов азота),
HCH=O + H2O (при 500oС в присутствии оксидов азота),
CH3−CH2−CH2−OH + O2 → CH3−CH2−CH=O + 2H2O.
При окислении вторичных спиртов образуются кетоны.
2. Каталитическое дегидрирование первичных спиртов.
CH3CH2−OH → CH3CH=O + H2.
При дегидрировании вторичных спиртов образуются кетоны.
3. Гидратация ацетилена (реакция Кучерова; лабораторный способ):
C2H2 + H2O → CH3CH=O.
При гидратации остальных альдегидов образуются кетоны.
4. Окисление алкена:
2C2H4 + O2 → 2CH3CH=O.
5. При щелочном гидролизе дигалогеналканов, содержащих два атома галогена при одном крайнем атоме углерода:
СН3–СНСI2 + 2NаОН → СН3–СН=О + НОН + 2NаСI.
При щелочном гидролизе внутренних атомов углерода с галогенами – образуются кетоны.
6. Оксосинтезом – присоединением СО и Н2 к алкенам:
СН3–СН=СН2 + СО + Н2 → СН3–СН2–СН2−СН=О.
7. Химические свойства альдегидов.
I. Реакции восстановления
1. При гидрировании альдегидов образуются первичные спирты:
СН3–СН=О + Н2 → СН3–СН2−О−Н
2. Присоединение гидросульфита натрия.
СН3–СH=О + NаНSО3 → СН3–СН−O(H)−SО3Nа
3. Присоединение одной молекулы спирта к альдегидам приводит к образованию полуацеталей, а двух молекул спирта к образованию ацеталей:
СН3–СH=О + С2Н5ОН → СН3–СH(OH)−O–С2Н5
СН3–СH=О + 2С2Н5ОН → СН3–СН(OС2Н5)–О−С2Н5 + НОH
4. Присоединение синильной кислоты.
СН3–СН=О + НСN → СН3–СН−О(Н)–C≡N
5. Присоединение воды к альдегидам приводит к образованию гидратов альдегидов.
СН3–СН=О + НОН → СН3–СН(OH)−ОН
II. Реакции окисления
1. Вступают в реакцию «серебряного зеркала» − реакцию взаимодействия с аммиачным раствором оксида серебра (I) при нагревании:
СН3–СН=О + 2[Ag(NН3)2]ОН → СН3−СООNН4 + 2Аg↓ + 3NН3↑ + Н2О.
В упрощенном виде реакцию записывают:
СН3–СОН + Аg2О → СН3–СООН + 2Аg↓.
Это качественная реакция на альдегидную группу – тонкий слой серебра на стенках химической посуды (пробирки).
2. Вступают в реакцию со свежеприготовленным раствором гидроксида меди(II) при нагревании:
СН3–СН=О + Сu+2(ОН)2↓→ СН3—СООН + 2Сu+ОН↓ + НОН,
голубой осадок желтый осадок
2Сu+ОН → Cu2+O↓ + H2O,
кирпично-красный осадок
или общая реакция
CH3CH=O + 2Cu+2(OH)2↓→ CH3COOH + 2H2O + Cu2+O↓.
Это качественная реакция на альдегидную группу – изменяющаяся гамма цветов в ходе реакции.
3. Горение альдегидов:
2CH3CH=O + 5O2 → 4CO2↑+ 4H2O
III. Реакции полимеризация альдегидов.
n(СН3)СH=О → (-(СН3)СН–О-)n
…+СН3–СH=О + СН3–СH=О + СН3–СH=О +…→…-(СН3)СH−О−(СН3)СH−О−(СН3)СH−О-…
IV. Реакции поликонденсации альдегидов – взаимодействие, например, формальдегида (метаналя) с фенолом при образовании фенолформальдегидной смолы.
nC6H5(OH) + nH−CH=O → (−C6H3(OH)−CH2−)n + (n-1)H2O
…+ C6H5 + H−CH=O + C6H5 + H−CH=O + C6H5 +…→…−C6H3−CH2−C6H3−CH2−C6H3−…+ 2H2O
| | | | | |
OH OH OH OH OH OH
V. Реакции замещения
1. Замещение атомов водорода в углеводородном радикале на галогены (замещение происходит в α-положение, т. е. замещается атом водорода у 2-го атома углерода):
CH3−СН2–СН=О + СI2 → CH3−СIСН–СН=О + НСI.
2. Замещение карбонильного кислорода галогенами:
СН3–СН=О + РСI5 → СН3–СН(СI)2 + РОСI3.
3. Замещение карбонильного кислорода на остаток гидроксиламина.
СН3–СН=О + Н2N−ОН → СН3–СH=N−ОН + H2O.
Вопросы: (для контроля знаний)
- Какие вещества относятся к альдегидам и как образуются названия их соединений?
- Какие виды изомерии характерны для альдегидов? Приведите примеры.
- При помощи каких реакций можно показать генетическую связь альдегидов с другими классами органической химии?
- Какие химические реакции характерны для альдегидов? Приведите уравнения реакций.
Список используемых источников:
- О.С. Габриелян и др. Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учрждений; Дрофа, Москва, 2005г.
- «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г.
- https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia/urok-no34-aldegidy-stroenie-molekuly-formaldegida-izomeria-i-nomenklatura
- http://sovety-tut.ru/uroki-himii/aldegidyi-i-ketonyi
- http://biofile.ru/bio/19872.html
| <== предыдущая лекция | | | следующая лекция ==> |
| Правильная рабочая поза | | | Взаимосвязь продуктовых инноваций и структуры отраслевого рынка |
Дата добавления: 2017-04-05; просмотров: 21398;











