Примеры расчета материальных балансов электролизеров
3.2.1. Математическая модель материального баланса ванны рафинирования меди
3.2.1.1. Исходные данные для расчета и начальные приближения
Рассмотрим процесс электролитического рафинирования меди. При составлении математической модели будем предполагать, что электролизер является зоной идеального смешения.
Примем, объем зоны идеального смешения, то есть объем электролита в ванне, постоянным и равным 3,58 м3 [19].
Для упрощения расчетов ограничимся следующим составом анодов (в долях единицы): Cu – 0,996; Ni – 0,004.
Состав электролита в ванне:
Сульфат меди – 100 г/л
Серная кислота – 190 г/л
Сульфат никеля – 44,8 г/л.
Сила тока на электролизере 16000 А, а коэффициент использования тока 96 % [19]. Собственно на электрохимический процесс идет ток
I=16000×0,96=15360 А.
Выходящий циркуляционный поток и электролит в ванне имеют одинаковый состав.
Основные реакции на электродах:
АНОД:
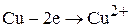 (3.73)
(3.73)
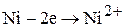 (3.74)
(3.74)
Химическая реакция растворения меди в присутствии кислорода:
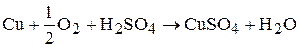 (3.75)
(3.75)
В качестве приближения примем, что ионов меди с зарядом +1 не образуются.
На аноде протекают псевдореакции перехода компонентов анода в шлам:
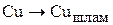 (3.76)
(3.76)
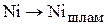 (3.77)
(3.77)
КАТОД:
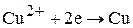 (3.78)
(3.78)
На катоде возможно включение никеля из раствора в катод:
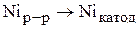 (3.79)
(3.79)
Общее количество компонентов электролита равно четырем: сульфат меди, серная кислота, сульфат никеля и вода.
3.2.1.2. Расчет коэффициентов в уравнении, определяющем плотность электролита как функцию состава
В соответствии с обычной практикой, примем, что плотность раствора линейно и аддитивно зависит от состава раствора. Вначале необходимо найти коэффициенты bi, учитывающие влияние отдельного компонента на плотность раствора. Для этого можно воспользоваться справочными данными [18] зависимости плотности растворов отдельных компонентов от их концентрации (табл. 3.1, 3.2 и 3.3).
Часто в справочной литературе приводятся значения концентраций (а), измеренной в вес.%. Для поиска коэффициентов bi необходимо, чтобы концентрация и плотность имели одинаковую размерность, лучше кг/м3. Пересчет концентрации выраженной в процентах на концентрацию в г/л производится по следующей формуле:
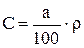 (3.83)
(3.83)
В таблицах 3.1, 3.2 и 3.3 в третьей колонке представлены рассчитанные по (3.83) значения концентраций.
Таблица 3.1.
Зависимость плотности растворов сульфата меди от концентрации [18] при температуре 20°С
| Концентрация сульфата меди, вес. % | 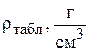
| Концентрация сульфата меди, г/л |
| 1,009 | 10,09 | |
| 1,019 | 20,38 | |
| 1,040 | 41,6 | |
| 1,062 | 63,72 | |
| 1,084 | 86,72 | |
| 1,107 | 110,7 | |
| 1,131 | 135,72 |
Таблица 3.2.
Зависимость плотности растворов сульфата никеля от концентрации [18] при температуре 20°С
| Концентрация сульфата никеля, вес. % | 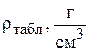
| Концентрация сульфата никеля, г/л |
| 1,009 | 10,09 | |
| 1,020 | 20,40 | |
| 1,042 | 41,68 | |
| 1,063 | 63,78 | |
| 1,085 | 86,80 | |
| 1,109 | 110,9 | |
| 1,133 | 135,96 |
Таблица 3.3.
Зависимость плотности растворов серной кислоты от концентрации [18] при температуре 20°С
| Концентрация серной кислоты, вес. % | 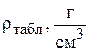
| Концентрация серной кислоты, г/л |
| 0,986 | 1,005 | 9,909 |
| 2,485 | 1,015 | 25,22 |
| 4,000 | 1,025 | 41,00 |
| 6,237 | 1,040 | 64,86 |
| 8,415 | 1,055 | 88,78 |
| 10,56 | 1,070 | 112,99 |
| 14,04 | 1,095 | 153,74 |
Для каждого компонента, кроме воды, коэффициент bi определяется по справочным данным следующим образом:
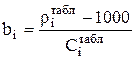 , (3.84)
, (3.84)
где 1000, кг/м3– плотность воды, а 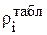 и
и 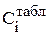 - значения плотности раствора и концентрации i-го компонента, кг/м3, взятые по справочнику (табл.3.1, 3.2 или 3.3).
- значения плотности раствора и концентрации i-го компонента, кг/м3, взятые по справочнику (табл.3.1, 3.2 или 3.3).
Расчет значений коэффициентов biудобно проводить в пакете MathCAD, используя метод наименьших квадратов в матричной форме [20]:
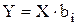 (3.85)
(3.85)
где -- X - вектор-столбец значений концентраций данного компонента 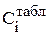 , кг/м3;
, кг/м3;
Y - вектор-столбец значений 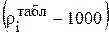 , кг/м3;
, кг/м3;
М – размер векторов X и Y равный числу пар значений 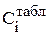 и
и 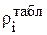 .
.
Для решения уравнения (3.86) обе его части необходимо умножить на транспонированный вектор X, то есть на 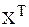
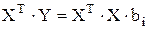 , (3.86)
, (3.86)
тогда в правой части получается квадратная матрица 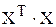 , для которой может быть найдена обратная матрица
, для которой может быть найдена обратная матрица 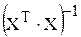 :
:
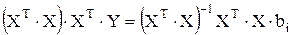 (3.87)
(3.87)
Произведение прямой матрицы на обратную дает единичную, тогда выражение для коэффициента bi принимает вид:
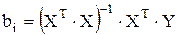 . (3.88)
. (3.88)
По данным таблиц 3.1-3.3 были рассчитаны значения коэффициентов bi, учитывающих влияние на плотность раствора концентрации сульфата меди, сульфата никеля и серной кислоты:
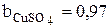 ,
,
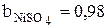 ,
,
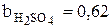 .
.
Выражения зависимости плотности раствора в ванне рафинирования от концентрации компонентов при температуре 200С в соответствии с (3.70 и 3.71) имеют вид:
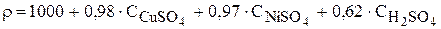 или
или
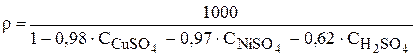 . (3.89)
. (3.89)
Для принятого состава электролита в ванне рафинирования плотность равна:
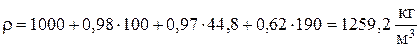 .
.
После этого могут быть рассчитаны безразмерные концентрации компонентов электролита в ванне рафинирования для начального момента времени:
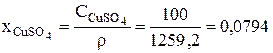
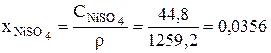
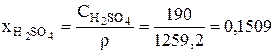
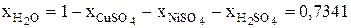
3.2.1.3. Расчет интенсивностей источников вещества
Для расчета источников компонентов в зоне идеального смешения ( 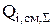 ), необходимо учесть все электродные и химические реакции, происходящие в электролизере.
), необходимо учесть все электродные и химические реакции, происходящие в электролизере.
1. Сульфат меди образуется в результате реакции электрохимического (3.73) и химического растворения (3.75) меди на аноде, а также его количество уменьшается вследствие восстановления ионов меди на катоде, поэтому суммарная интенсивность источников сульфата меди равна:
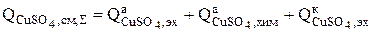 (3.90)
(3.90)
Скорость накопления сульфата меди в растворе по анодной реакции определяется законом Фарадея:
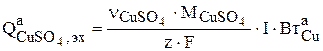 (3.91)
(3.91)
где 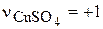 - стехиометрический коэффициент при ионах Cu2+ в уравнении (3.73), которые в растворе образуют сульфат меди.
- стехиометрический коэффициент при ионах Cu2+ в уравнении (3.73), которые в растворе образуют сульфат меди. 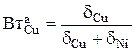 - анодный выход по току меди зависит от массовых долей электрохимически растворимых компонентов анода (в нашем примере – это медь и никель):
- анодный выход по току меди зависит от массовых долей электрохимически растворимых компонентов анода (в нашем примере – это медь и никель):
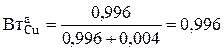 .
.
Для заданных условий
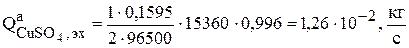
Интенсивность, с которой увеличивается количество сульфата меди в растворе в результате химической реакции (3.75) зависит от скорости этой реакции 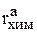 :
:
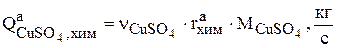 (3.92)
(3.92)
На основе практических данных установлено, что химически растворяется 3,4 % [19]от электрохимически растворимой части анода. Тогда скорость реакции химического растворения в расчете на всю ванну равна:
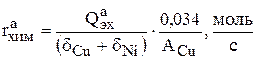 (3.93)
(3.93)
Здесь 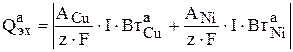 - скорость, с которой анод растворяется под действием тока, то есть электрохимически. Для заданных условий:
- скорость, с которой анод растворяется под действием тока, то есть электрохимически. Для заданных условий:
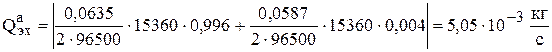
С учетом приведенных данных, скорость реакции химического растворения анодов равна
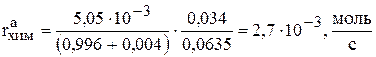 ,
,
а скорость накопления сульфата меди
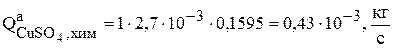 .
.
В результате восстановления ионов меди на катоде (3.78) количество сульфата меди в растворе уменьшается со скоростью:
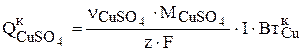 (3.94)
(3.94)
Так как стехиометрический коэффициент ионов меди в уравнении (3.78) равен -1, а выход по току 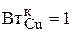 , то можно записать:
, то можно записать:
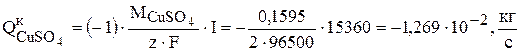
Суммарная интенсивность источников для сульфата меди в ванне рафинирования меди равна:
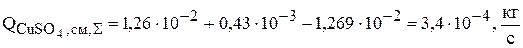
2. Сульфат никеля накапливается в растворе в результате растворения на аноде никеля по реакции (3.74), а по реакции (3.79) никель из раствора зарабатывается в катод и количество его в растворе уменьшается:
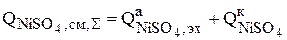 (3.95)
(3.95)
Скорость накопления сульфата никеля в растворе в результате его растворения на аноде рассчитывается по закону Фарадея:
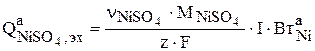 (3.96)
(3.96)
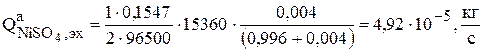
На основе экспериментальных данных установлено [19], что скорость зарабатывания никеля в катод по реакции (3.79) пропорциональна количеству меди, восстановленной на катоде ( 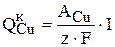 ). После ряда преобразований была получена эмпирическая зависимость скорости псевдореакции от концентрации сульфата никеля в растворе
). После ряда преобразований была получена эмпирическая зависимость скорости псевдореакции от концентрации сульфата никеля в растворе 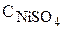 :
:
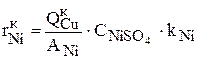 (3.97)
(3.97)
Здесь 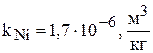 - эмпирический коэффициент, учитывающий связь между концентрацией никеля в растворе и в катоде.
- эмпирический коэффициент, учитывающий связь между концентрацией никеля в растворе и в катоде.
Интенсивность уменьшения количества сульфата никеля в растворе за счет зарабатывания его в катод равна:
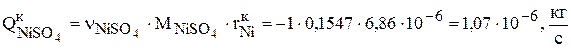
Суммарная интенсивность изменения количества сульфата никеля в растворе равна:
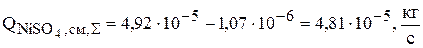
3. Серная кислота расходуется по реакции (3.75) химического растворения меди, поэтому суммарная интенсивность источников для серной кислоты равна скорости изменения ее количества за счет химической реакции:
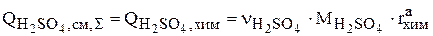 (3.98)
(3.98)
Скорость химической реакции была рассчитана по уравнению (4.93). Так как 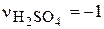 , то
, то
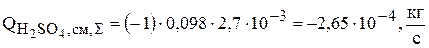
4. Суммарная интенсивность источников для воды определяется скоростью образования воды вследствие протекания реакции химического растворения анодов, а также уменьшением количества воды в результате ее испарения, то есть перехода из одного агрегатного состояния в другое:
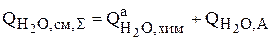 (3.99)
(3.99)
Здесь 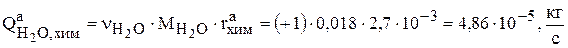 .
.
Интенсивность конвективного уноса паров воды рассчитывается с учетом площади поверхности зеркала электролита 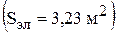 :
:
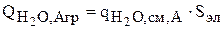 , (3.100)
, (3.100)
где в соответствии с (3.65)
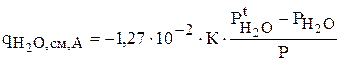 .
.
Поверхность зеркала электролита рассчитывается, как разница между площадью поперечного сечения ванны и площадями поперечного сечения электродов и других деталей электролизера, пересекающих поверхность раствора.
Для ванны рафинирования меди, температура электролита в которой равна 600С, скорость испарения воды равна
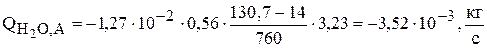 .
.
Значения парциального давления паров воды над электролитом при температуре электролита ( 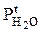 ) и парциального давления паров воды при температуре внешней среды и данной влажности (
) и парциального давления паров воды при температуре внешней среды и данной влажности ( 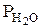 ) выбираются из справочника [21] и пересчитываются на конкретные условия работы ванны (по температуре и влажности).
) выбираются из справочника [21] и пересчитываются на конкретные условия работы ванны (по температуре и влажности).
Суммарная интенсивность источников для воды равна:
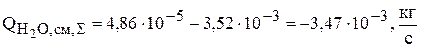 .
.
3.2.1.4. Нестационарный материальный баланс ванны рафинирования меди
Расчет нестационарного материального баланса строится в форме таблицы в пакете Excel в соответствии с приведенными ранее формулами (3.1÷3.4). Фрагмент такой таблицы представлен на рис. 3.2.

Рис. 3.2. Фрагмент таблицы расчета нестационарного материального баланса
В приведенном фрагменте не приведены колонки, содержащие расчет приращения всех компонентов. Расчета интенсивности источника вещества дан только для никеля, поскольку остальные источники являются постоянными. Они вынесены за поле таблицы. Первая строка приведенной таблицы отличается от последующих. Как уже отмечалось, она включает начальные значения массовых долей всех компонентов, нулевое значение времени, формулу расчета плотности раствора по массовым долям, приведенным в данной строке и формулу расчета интенсивности источника для никеля. Остальные величины, кроме концентраций компонентов (С), содержат не формулы, а числа. Числовые значения этих величин получены при решении системы уравнений в MathCAD (рис.3.3. и 3.4).

Рис. 3.3. Исходные данные и условные обозначения, использованные при решении системы уравнений в MathCAD.
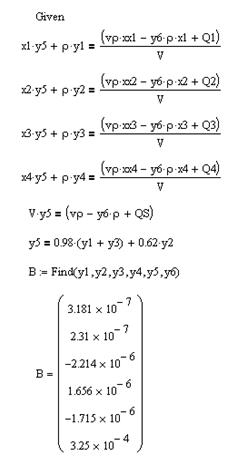
Рис. 3.4. Решение системы уравнений для расчета значений приращений в первой строке таблицы расчета материального баланса
На основе таблицы материального баланса в Excel строятся графики изменения концентраций основных компонентов во времени. С помощью полученной модели нестационарного материального баланса, можно подобрать состав входящего раствора таким образом, чтобы в ванне поддерживались заданные концентрации компонентов в рамках технологического регламента.
3.2.1.5. Стационарный материальный баланс ванны рафинирования меди
Рассмотрим составление модели стационарного материального баланса на примере электролизера для рафинирования меди с непрерывной циркуляцией электролита.
Цель расчетов:
1. Определить состав циркуляционного потока электролита на входе в ванну при условии, что электролит в ванне остается неизменным по составу.
2. Найти расход реагентов за определенный промежуток времени работы электролизера.
3. Рассчитать распределение материалов и компонентов при рафинировании 1000кг анодного металла.
Определение скорости и состава потока циркуляции на входе в ванну
Электролит в ванну рафинирования меди подается с помощью насосов, а отводится самотеком через сливной карман. Необходимо рассчитать состав входящего циркуляционного потока электролита 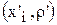 и его скорость
и его скорость 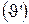 ,считая, что состав электролита в ванне известен
,считая, что состав электролита в ванне известен 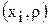 и не изменяется во времени. Скорость циркуляции электролита на выходе из ванны равна
и не изменяется во времени. Скорость циркуляции электролита на выходе из ванны равна 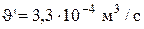 [19].
[19].
Указанные величины находятся в результате решения системы уравнений стационарного материального баланса (4.38 - 4.40):
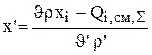 (3.80)
(3.80)
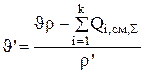 (3.81)
(3.81)
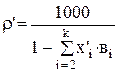 (3.82)
(3.82)
Таким образом, все величины, необходимые для проведения расчетов по системе уравнений (3.80-3.82), определены. Систему уравнений легко можно решить с помощью ЭВМ. Расчеты показывают, что для поддержания постоянного состава электролита в ванне (100г/л CuS04, 44,8г/л NiS04 и 190г/л H2S04), циркуляционный поток на входе в ванну должен иметь следующий состав: 97,91 г/л CuS04, 44,18 г/л NiSO4, и 188,76 г/л H2SO4. Подаваться электролит в ванну должен со скоростью 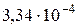 м3/с.
м3/с.
Полученные результаты свидетельствуют о том, что для поддержания постоянного состава электролита в ванне необходимо подавать на вход раствор с более низкой концентрацией сульфата меди и никеля. Концентрация серной кислоты во входящем потоке по расчетам получилась несколько ниже, чем в объеме ванны. Однако, вследствие интенсивного испарения воды объемная скорость потока на входе выше, чем скорость потока на выходе из ванны. Если учесть разность объемных скоростей то получается, что скорость поступления кислоты в ванну ( 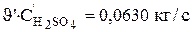 ) больше, чем скорость отвода ее из ванны (
) больше, чем скорость отвода ее из ванны ( 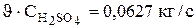 ), следовательно, недостаток кислоты восполняется.
), следовательно, недостаток кислоты восполняется.
Расход реагентов за месяц работы электролизера
Часто требуется рассчитать расход реагентов за месяц работы электролизера. Расход реагентов за месяц работы ванны рафинирования меди определяется величиной суммарной интенсивности источников по каждому компоненту (ур.3.44):
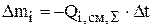
За месяц работы электролизера интервал времени 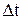 рассчитывается с учетом коэффициента машинного времени (
рассчитывается с учетом коэффициента машинного времени ( 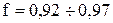 ) [19]:
) [19]:
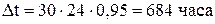
Значения 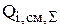 по основным компонентам рассчитаны в предыдущей задаче. Если суммарная интенсивность источников для вещества величина положительная, следовательно, данное вещество накапливается в растворе и его избыток необходимо отводить. Количество вещества, накапливающееся в электролите, рассчитывается по уравнению (3.44) и имеет знак минус. Так за месяц работы избыток сульфата меди и никеля составит соответственно:
по основным компонентам рассчитаны в предыдущей задаче. Если суммарная интенсивность источников для вещества величина положительная, следовательно, данное вещество накапливается в растворе и его избыток необходимо отводить. Количество вещества, накапливающееся в электролите, рассчитывается по уравнению (3.44) и имеет знак минус. Так за месяц работы избыток сульфата меди и никеля составит соответственно:
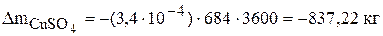
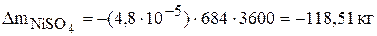
Если величина 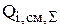 отрицательна, значит данное вещество в процессе электролиза расходуется и его необходимо добавлять в электролит в количестве
отрицательна, значит данное вещество в процессе электролиза расходуется и его необходимо добавлять в электролит в количестве 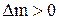 . За месяц работы электролизера необходимо добавить следующее количество серной кислоты и воды:
. За месяц работы электролизера необходимо добавить следующее количество серной кислоты и воды:
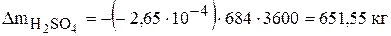
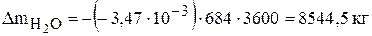
В действующем производстве электролит, выходящий из ванны
рафинирования, разделяется на три потока [10]. Один поток отправляется в купоросный цех, где после упаривания раствора получают
сульфат меди и никеля. Второй поток направляют в ванны регенерации, где происходит обезмеживание электролита. Обезмеженный электролит возвращается затем в процесс рафинирования. Третья часть
электролита из ванны рафинирования собирается в сборную емкость,
в которой электролит корректируют, добавляя воду и серную кислоту, при этом содержание сульфатов меди и никеля понижается. Из
сборной емкости электролит подается на вход электролизера для рафинирования меди.
Распределение материалов и компонентов при рафинировании 1000кг анодного металла
Требуется рассчитать распределение 1000кг анодного металла между раствором, катодом и шламом. Расчет провести по всем компонентам анода.
Первоначально необходимо рассчитать интенсивности растворения или перехода в раствор компонентов анода.
Медь растворяется на аноде электрохимически (ур.3.73), химически (ур.3.75) и переходит в шлам по псевдореакции (ур.3.76). Интенсивность электрохимического растворения меди рассчитывается по закону Фарадея:
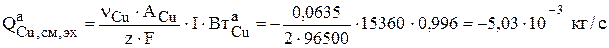 .
.
Скорость реакции химического растворения меди 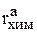 определена в разделе 3.2.1.3. Поэтому интенсивность химического растворения меди равна
определена в разделе 3.2.1.3. Поэтому интенсивность химического растворения меди равна
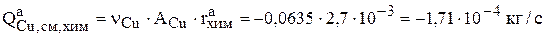 .
.
В соответствии с эмпирическими данными интенсивность перехода меди в шлам составляет 0.07% [19] от количества электрохимически растворенной меди:
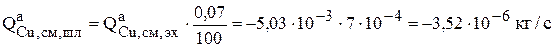
Никель, содержащийся в анодах, растворяется электрохимически (ур. 3.74) в соответствии с законом Фарадея:
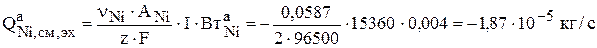 .
.
Масса никеля, которая переходит в шлам (ур. 3.77), составляет 10% [19] от массы никеля, электрохимически растворяющегося на аноде, поэтому
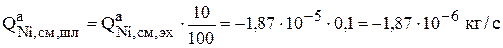
Когда рассчитаны источники по всем компонентам на аноде, можно определить время растворения 1000 кг анодного металла (ур.3.29):
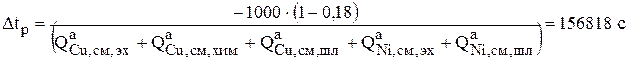 или 43,56 часа.
или 43,56 часа.
Чтобы рассчитать баланс распределения компонентов анода осталось найти интенсивность перехода металлов анода на катод.
Количество меди, выделившейся на катоде, равно:
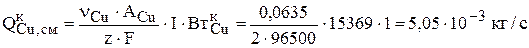
Скорость псевдореакции зарабатывания никеля, находящегося в растворе, в катод уже рассчитывалась в предыдущем разделе 3.2.1.3. Интенсивность зарабатывания никеля в катод равна:
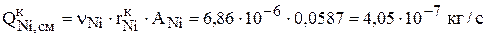 .
.
По уравнению (3.32) можно найти интенсивности перехода меди и никеля с анода в раствор:
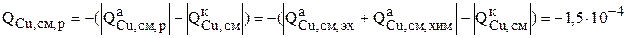 кг/с
кг/с
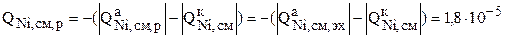 кг/с.
кг/с.
Следующим шагом расчета является определение количества меди и никеля, которое перешло с анода в раствор (3.33), в шлам (3.31) и на катод (3.30) за рассчитанное время 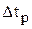 :
:
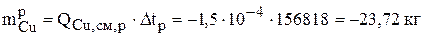
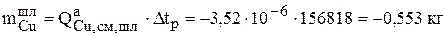
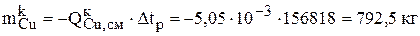
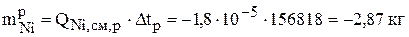
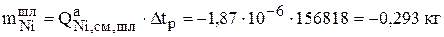
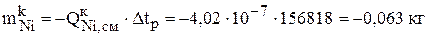
Знак «минус» означает, что рассчитанное количество металла ушло с анода.
По результатам расчетов содержание никеля в катодах составляет 0.08%, что несколько выше, чем в производстве [10]. Это несоответствие объясняется тем, что в расчетах в качестве примесей анодной меди рассматривался только никель и не учитывались другие составляющие.
Теперь можно рассчитать распределение меди, содержащейся в 1000кг анодного металла между катодом 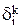 , шламом
, шламом 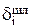 и раствором
и раствором 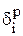 в процентах по уравнениям (3.34):
в процентах по уравнениям (3.34):
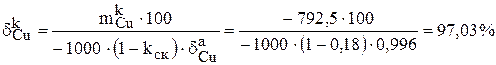
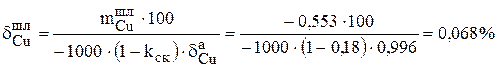
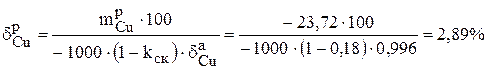
Аналогично рассчитывается распределение никеля, содержащегося в 1000кг анодного металла. Результаты расчета баланса распределения анодного металла при рафинировании меди представлены в таблице 3.4.
Таблица 3.4
Баланс распределения 1000кг анодного металла в процессе рафинирования меди
| Распределение анодной меди | Медь | Никель | ||
| кг | % | кг | % | |
| Раствор | 23,72 | 2,89 | 2,87 | 89,15 |
| Шлам | 0,553 | 0,068 | 0,293 | 8,93 |
| Катоды | 792,5 | 97,03 | 0,063 | 1,92 |
3.2.1. Нестационарный материальный баланс гальванической ванны для нанесения покрытий
Расчет нестационарного материального баланса рассмотрим на примере работы гальванической ванны нанесения цинкового покрытия. Ванна непроточная, поэтому в результате происходящих процессов (например, испарения воды) объем электролита в ней не остается постоянным (рис.3.5).
Цель расчета нестационарного материального баланса: проследить за изменением во времени объема и состава раствора в гальванической ванне; по результатам расчетов определить время корректировки электролита.

Рис. 3.5. Схематичное изображение потоков в гальванической ванне.
Исходные данные для расчета материального баланса.
Электролит в ванне цинкования имеет следующий состав:
ZnO – 15 г/л, NaOH –120 г/л и органические добавки.
Примем допущение, что добавки расходуются с малой скоростью, поэтому при составлении баланса их рассматривать не будем. В данном электролите цинк находится в виде гидроксокомплексов с различным количеством лигандов, однако, для простоты представим процесс растворения оксида цинка следующим образом:
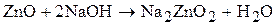
В этом случае компонентами при составлении материального баланса будут являться цинкат натрия, свободная щелочь и вода. Количество молей цинката натрия в растворе равно количеству молей оксида цинка, то есть 0,184 моль/л. С учетом молярной массы цинката натрия его концентрация равна 26,4 г/л. Исходная молярная концентрация щелочи равна 3 моль/л, а концентрация свободной щелочи в растворе (3-0,184)=2,816 моль/л или 112,6г/л.
Необходимо нанести покрытие толщиной 15 мкм (плотность цинка 7100 кг/м3). Покрытие наносят при плотности тока 2 А/дм2. Выход по току при осаждении цинка 96%. Температура электролита 250С, а окружающей среды 200С.
По справочнику [12] выбираем размеры ванны нанесения покрытия 1250x800x1000 мм. Высоту электролита в ванне улавливания принимаем равной 800 мм. В момент начала расчета (t=0) объем электролита равен 0,8м3. Единовременная загрузка такой ванны при обработке деталей на подвесках составляет по данным справочника [12] 0,63 м2. С учетом поверхности подвески площадь Sдет=0,8 м2. Количество электролита, уносимого с покрываемыми деталями C=0,2л/м2 [9].
Входящий поток ( 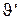 ) в ванне цинкования представляет собой воду (
) в ванне цинкования представляет собой воду ( 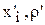 ), которую приносят с собой детали, поступающие в ванну нанесения покрытия из ванны промывки, поэтому
), которую приносят с собой детали, поступающие в ванну нанесения покрытия из ванны промывки, поэтому
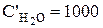
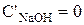
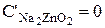
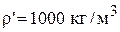
Поток на выходе (  ) - это раствор, уносимый из ванны покрытия (
) - это раствор, уносимый из ванны покрытия ( 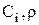 ) с деталями (рис.3.5).
) с деталями (рис.3.5).
Детали загружаются и выгружаются из ванны улавливания периодически, поэтому входящий и выходящий потоки можно назвать псевдонепрерывными, их скорость рассчитывается по уравнению 3.11:
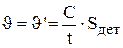
где С - количество электролита, уносимого с 1м2 поверхности покрываемых деталей, м3/м2; 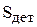 - площадь покрываемых деталей и подвески, м2.
- площадь покрываемых деталей и подвески, м2.
Общее время обработки детали (t) в ванне основного покрытия (время одного технологического цикла) определяется по формуле (2.13):
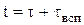 ,
,
где 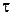 - время нанесения покрытия, которое рассчитывается по ур. (2.1)
- время нанесения покрытия, которое рассчитывается по ур. (2.1)
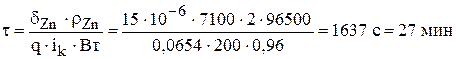
и 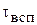 - время на обслуживание ванны, которое составляет, как правило 5-7 минут.
- время на обслуживание ванны, которое составляет, как правило 5-7 минут.
Скорость псевдонепрерывных потоков равна:
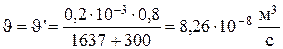 .
.
Система уравнений нестационарного материального баланса для гальванической непроточной ванны может быть представлена уравнениями 3,4, 3.19-3.20:
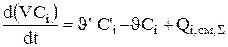
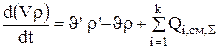
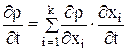
После дифференцирования 3.4 получили выражение для изменения плотности:
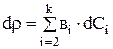
Окончательно система уравнений нестационарного материального баланса ванны цинкования выглядит следующим образом:
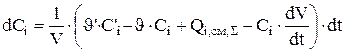 (3.101)
(3.101)
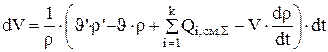 (3.102)
(3.102)
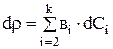 (3.103)
(3.103)
Уравнение 3.101 записывается для каждого компонента (для цинката натрия, гидроксида натрия и воды).
Расчет баланса проводится методом численного интегрирования по времени (3.17). На n-ом шаге расчета значения концентраций компонентов, объема, плотности и времени находятся суммированием значений соответствующих величин на (n-1)-ом шаге расчета и изменений их на текущем шаге:
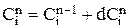
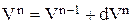
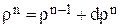
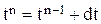
До начала расчетов необходимо найти 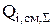 для гидроксида натрия, цинката натрия и воды. Для этого необходимо записать реакции, происходящие в гальванической ванне:
для гидроксида натрия, цинката натрия и воды. Для этого необходимо записать реакции, происходящие в гальванической ванне:
Катод
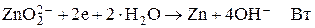
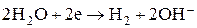 (1-Вт)
(1-Вт)
Анод
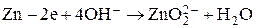
Суммарное уравнение реакций, протекающих на электродах, выглядит следующим образом:
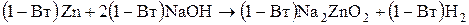 .
.
Тогда можно определить суммарные интенсивности источников гидроксида натрия и цинката натрия, кг/с:
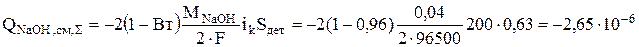
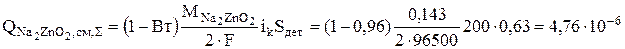 Концентрация воды не должна изменяться в результате реакций, но количество воды уменьшается вследствие испарения. Интенсивность этого процесса рассчитывается по уравнению (3.65)
Концентрация воды не должна изменяться в результате реакций, но количество воды уменьшается вследствие испарения. Интенсивность этого процесса рассчитывается по уравнению (3.65)
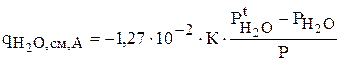
С учетом площади испарения имеем:
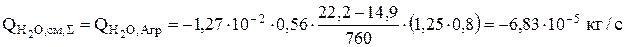 Кроме того, необходимо учесть равновесное испарение, которое происходит вследствие выделения пузырьков газообразного водорода на катоде. Скорость уноса воды рассчитывается по ур. 3.62 с учетом интенсивности выделения водорода (ур.3.63).
Кроме того, необходимо учесть равновесное испарение, которое происходит вследствие выделения пузырьков газообразного водорода на катоде. Скорость уноса воды рассчитывается по ур. 3.62 с учетом интенсивности выделения водорода (ур.3.63).
Расчет нестационарного материального баланса проводится на основе начальных условий: значения концентраций, плотности и объема электролита в момент начала расчета, то есть t=0. Начальный состав электролита соответствует выбранному составу:
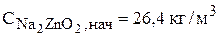
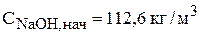 .
.
По справочным данным [18] были найдены значения коэффициентов, учитывающих влияние отдельных компонентов на плотность раствора:
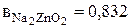 и
и 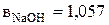 .
.
Плотность электролита в момент начала расчета равна:
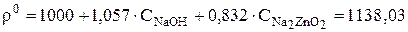 кг/м3
кг/м3
Начальный объем электролита: 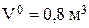 .
.
Порядок расчета баланса следующий. На первом шаге расчета принимают
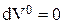 и
и 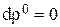
и на основе начальных условий проводят расчет 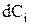 по уравнениям (3.101), затем по (3.102) и (3.103) определяют изменения объема и плотности. После этого с помощью уравнений численного интегрирования (3.104 - 3.107) определяют значения концентраций, объема, плотности и времени, соответствующие началу второго шага расчета. На втором и последующем шагах расчета учитывают изменения объема и плотности, которые рассчитываются на предыдущем шаге.
по уравнениям (3.101), затем по (3.102) и (3.103) определяют изменения объема и плотности. После этого с помощью уравнений численного интегрирования (3.104 - 3.107) определяют значения концентраций, объема, плотности и времени, соответствующие началу второго шага расчета. На втором и последующем шагах расчета учитывают изменения объема и плотности, которые рассчитываются на предыдущем шаге.
Результаты расчета материального баланса изменения состава электролита в ванне цинкования представлены в таблице 3.5. В результате расчета установлено, что в процессе работы гальванической ванны цинкования происходит увеличение концентрации цинката натрия и уменьшение концентрации едкого натра (рис. 3.6). Одновременно наблюдается уменьшение уровня электролита (рис. 3.7) в ванне. Полученные данные могут быть использованы для того, чтобы определить необходимость и периодичность корректировки электролита.
Таблица 3.5.
Изменение во времени объема электролита и концентраций компонентов ванны цинкования деталей на подвесках
| Время, час | 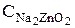 ,г/л ,г/л
| 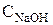 , г/л , г/л
| V, м3 |
| 26,43 | 112,63 | 0,800 | |
| 26,44 | 112,60 | 0,800 | |
| 26,46 | 112,57 | 0,800 | |
| 26,48 | 112,54 | 0,799 | |
| 26,49 | 112,51 | 0,799 | |
| 26,51 | 112,48 | 0,799 | |
| 26,53 | 112,46 | 0,799 |

| |
| |
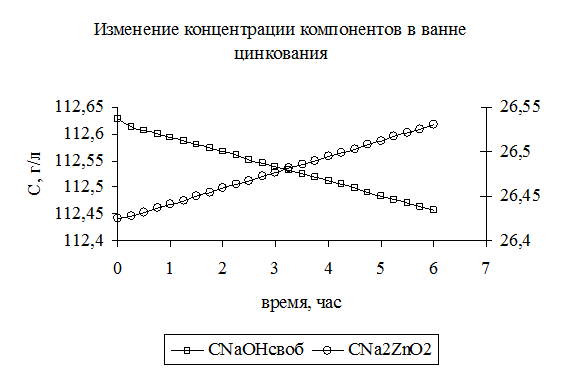
Рис. 3.6. Изменение во времени концентрации свободной щелочи (1) и цинката натрия (2) в ванне цинкования.

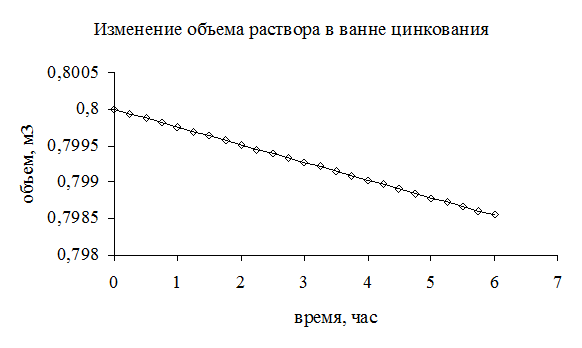
Рис. 3.7. Изменение во времени объема электролита в ванне цинкования.
В результате расчета установлено, что в процессе работы гальванической ванны цинкования происходит увеличение концентрации цинката натрия и уменьшение концентрации едкого натра (рис.3.3). Одновременно наблюдается уменьшение уровня электролита (рис.3.4) в ванне. Полученные данные могут быть использованы для того, чтобы определить необходимость и периодичность корректировки электролита.
В первом приближении время корректировки можно рассчитать следующим образом. В технологическом регламенте, как правило, оговариваются допустимые пределы изменения концентраций компонентов
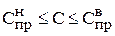 . (3.104)
. (3.104)
Это позволяет определить максимально возможное изменение концентрации каждого компонента как в случае уменьшения концентрации
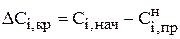 , (3.105)
, (3.105)
так и в случае ее увеличения в ходе процесса
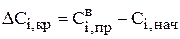 . (3.106)
. (3.106)
Скорость изменения концентрации i-го компонента раствора 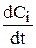 может быть определена из графиков зависимости концентрации от времени (рис. 3.6). В общем случае это будет тангенс угла наклона касательной к кривой. При линейном изменении концентрации от времени (рис. 3.6) производную можно заменить на конечные разности и рассчитать, как тангенс угла наклона прямой:
может быть определена из графиков зависимости концентрации от времени (рис. 3.6). В общем случае это будет тангенс угла наклона касательной к кривой. При линейном изменении концентрации от времени (рис. 3.6) производную можно заменить на конечные разности и рассчитать, как тангенс угла наклона прямой:
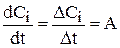 (3.107)
(3.107)
По известной скорости изменения концентрации можно определить время достижения критического значения концентрации, то есть время корректировки 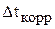 .
.
Так как 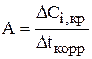 , то
, то 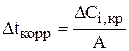 . (3.108)
. (3.108)
Аналогичным образом можно определить время корректировки уровня электролита в ванне. В соответствии с рис. 3.7 объем электролита в ванне цинкования меняется во времени по линейному закону. То есть:
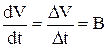 (3.109)
(3.109)
Если учесть, что 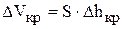 , то можно рассчитать время, через которое необходимо доливать в ванну электролит или корректировочный раствор:
, то можно рассчитать время, через которое необходимо доливать в ванну электролит или корректировочный раствор:
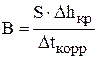 и
и 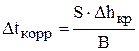 . (3.110)
. (3.110)
При этом максимально возможное снижение уровня электролита ( 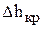 ) зависит от конструкции подвески и расположением на ней покрываемых деталей.
) зависит от конструкции подвески и расположением на ней покрываемых деталей.
Для
Дата добавления: 2016-06-05; просмотров: 3766;










