Эффект Джоуля – Томсона
Эффектом Джоуля-Томсона называют изменение температуры при протекании газа под действием перепада давлений сквозь какое-либо локальное препятствие – дроссель. Дросселем может служить пористая перегородка, узкий участок трубки, вентиль и т.п. Система, в которой наблюдается процесс Джоуля-Томсона (процесс дросселирования), изображена на рис. 19.1.
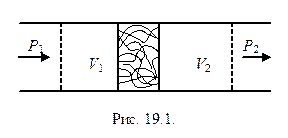 В теплоизолированной трубке помещена пробка из пористого материала. Под действием разности давлений газ медленно протекает через перегородку. Благодаря медленности процесса в газе не возникает турбулентных течений. Кроме того, можно пренебрегать кинетической энергией упорядоченного движения. В таких условиях состояния газа по обе стороны перегородки можно считать равновесными. На начальных этапах процесса пробка и газ обменивались теплотой. С течением времени процесс становится стационарным, внутренняя энергия пробки перестает меняться. Слева от перегородки давление газа Р1 и температура Т1 поддерживаются постоянными. При стационарном течении по правую сторону перегородки устанавливается давление Р2, которое всегда меньше Р1, и температура Т2. Если газ охлаждается (Т2 < T1) эффект Джоуля-Томсона называется положительным, а если нагревается (T2 > T1) – отрицательным.
В теплоизолированной трубке помещена пробка из пористого материала. Под действием разности давлений газ медленно протекает через перегородку. Благодаря медленности процесса в газе не возникает турбулентных течений. Кроме того, можно пренебрегать кинетической энергией упорядоченного движения. В таких условиях состояния газа по обе стороны перегородки можно считать равновесными. На начальных этапах процесса пробка и газ обменивались теплотой. С течением времени процесс становится стационарным, внутренняя энергия пробки перестает меняться. Слева от перегородки давление газа Р1 и температура Т1 поддерживаются постоянными. При стационарном течении по правую сторону перегородки устанавливается давление Р2, которое всегда меньше Р1, и температура Т2. Если газ охлаждается (Т2 < T1) эффект Джоуля-Томсона называется положительным, а если нагревается (T2 > T1) – отрицательным.
Рассмотрим прохождение через перегородку некоторой порции газа. Пусть по левую сторону от дросселя она имела объем V1и внутреннюю энергию U1, а после прохождения имеет объем V2 и внутреннюю энергию U2. Полученное газом тепло равно нулю, так как в стационарных условиях теплообмен между газом и пробкой уже прекратился, а стенки трубки адиабатические. Тогда изменение внутренней энергии равно работе, произведенной над газом внешними силами.
 .
.
Это соотношение можно переписать в виде
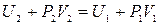 ,
,
или, вспомнив, что энтальпия H = U + PV,
Н2 = Н1.
Таким образом, в процессе Джоуля-Томсона энтальпия газа остается неизменной.
Так как энтальпия идеального газа зависит только от температуры, то из постоянства энтальпии следует, что температура идеального газа в процессе Джоуля-Томсона не меняется. Для реальных газов процесс сопровождается либо нагреванием, либо охлаждением. Поскольку при дросселировании всегда 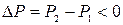 , знак эффекта определяется знаком отношения
, знак эффекта определяется знаком отношения 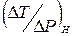 . Если рассматривать дифференциальный эффект Джоуля-Томсона, когда перепад давлений мал (
. Если рассматривать дифференциальный эффект Джоуля-Томсона, когда перепад давлений мал ( 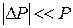 ), можно считать
), можно считать
 .
.
Чтобы найти производную (¶T/¶P)H запишем дифференциал энтальпии в переменных температура и объем Н = Н(Т,Р) и приравняем его нулю
 .
.
Из этого следует
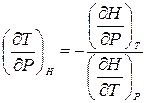 . (19.1)
. (19.1)
Так как 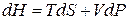 , то
, то 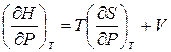 .
.
Используя соотношение Максвелла (16.8), получим
 . (19.2)
. (19.2)
Учитывая, что 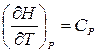 , можно записать
, можно записать
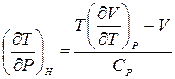 . (19.3)
. (19.3)
Теплоемкость СР всегда больше нуля, поэтому знак эффекта Джоуля-Томсона определяется знаком числителя правой части равенства (19.3). Чтобы его определить, достаточно знать уравнение состояния газа. Если газ идеальный, то 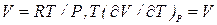 , а потому DТ = 0. Изменение температуры реальных газов будет рассмотрено позднее, когда в нашем распоряжении будут уравнения состояния реальных газов.
, а потому DТ = 0. Изменение температуры реальных газов будет рассмотрено позднее, когда в нашем распоряжении будут уравнения состояния реальных газов.
Наряду с дифференциальным эффектом рассматривают также интегральный эффект Джоуля-Томсона. В этом случае перепад давлений велик, и может составлять десятки и даже сотни атмосфер. Изменения температуры тоже значительны. Поэтому интегральный эффект применяется для получения низких температур. При вычислении изменения температуры можно рассматривать интегральный эффект как последовательность дифференциальных эффектов. Таким путем приходим к выражению
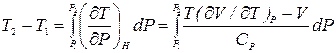 . (19.4)
. (19.4)
При практическом использовании эффекта Джоуля-Томсона часто бывает, что в исходном состоянии газ находится под высоким давлением, а после дросселирования давление падает настолько низко, что газ можно считать идеальным. В этом случае изменение температуры проще найти не по формуле (19.4), а непосредственно пользуясь равенством энтальпий в начальном и конечном состояниях. Соответствующий расчет будет проведен позднее для газа Ван-дер-Ваальса.
Дата добавления: 2017-03-12; просмотров: 9229;











