Растворение осадков
В ходе анализа необходимо не только получить осадок, осадив определяемый компонент в виде малорастворимого соединения, но и вновь растворить его. Для растворения осадков необходимо, чтобы произведение концентраций ПК осадка стало меньше произведения растворимости ПК< ПР. Достигнуть этого можно следующим образом.
1. Сильно разбавить раствор.
Разбавляют до тех пор, пока концентрация осадка не станет равной его растворимости.
2. Связывание ионов осадка в слабо ионизирующее соединение, хорошо растворимое в воде. Например, гидроксид магния легко растворяется в кислотах, вследствие связывания годроксильных ионов с ионами водорода в очень слабо диссоциирующее соединение – воду.
Mg(OH)2↓ + 2H+ ó Mg2+ + 2H2O
Но ведь OH-ионы можно также связывать путем введения в растворе ионов аммония, причем образунтся сравнительно мало диссоциированное соединение – гидроксид аммония:
Mg(OH)2↓ + 2NH4+ ó Mg2+ + 2NH4OH
Т.е. гидроксид магния растворяется в солях аммония. Однако NH4OH ионизирован гораздо сильнее, чем вода. Поэтому не происходит такого сильного понижения концентрации гидроксильных ионов в растворе, как при добавлении кислоты. Следовательно, растворяющее действие солей аммония значительно слабее действия кислот. В солях аммония растворяются только некоторые, наиболее растворимые основания. Наоборот, Mg(OH)2, Mn(OH)2. Fe(OH)3, Cr(OH)3, Al(OH)3 не растворяются в солях аммония и в уксусной кислоте, а растворяются в сильных минеральных кислотах. Т.е. чем меньше константа диссоциации образующегося электролита, тем легче протекает растворение осадка.
Малорастворимые кислые соли растворяются и в кислотах, и в щелочах. Например, калий обнаруживают в растворах реакцией с гидротартратом натрия. Происходит реакция и выпадает белый кристаллический осадок:
K+ + HC4H4O6– ó KHC4H4O6↓
Осадок выпадает только в нейтральной или слабощелочной среде (рН 4 –7) при достаточно большой концентрации K+ в растворе. И в щелочной, и в кислой среде осадок растворяется:
KHC4H4O6↓ + H+ ó H2C4H4O6 + K+
KHC4H4O6↓ + OH– ó K+ + C4H4O62– + H2O (в уксусной кислоте не растворяется).
Малорастворимые соли слабых кислот растворяются в кислотах вследствие связывания аниона соли с Н+-ионами в недиссоциированные молекулы слабой кислоты:
ZnS↓ + H+ ó Zn2+ + HS–
HS– + H+ ó H2S
3. Протекание реакций комплексообразования.
Например:
AgCl↓ + 2NH3 ó [Ag(NH3)2]Cl
В то же время менее растворимые галогениды серебра AgBr и AgI аммиак не растворяет.
Свежеосажденный фторид кальция не растворим в кислотах, но растворим в солях алюминия вследствие образования прочных фторидных комплексов:
CaF2↓ + Al3+ ó [AlF2]+ + Ca2+
Фторид кальция растворим также в ЭДТА вследствие образования комплексоната кальция:
CaF2↓ + H2Y2– ó [CaY]2– + 2H+ + 2F–
4. Протекание реакций окисления-восстановления.
Сульфиды 4й группы не растворяются в соляной кислоте, но растворяются в кислоте-окислителе – азотной кислоте:
3CuS↓ + 8HNO3 ó 3Cu(NO3)2 + 3S + 2NO +4H2O
5. Комбинированное растворение.
Когда осадок не растворяется ни в одном из приведенных случаев, применяют комбинированное растворение, в котором сочетают несколько факторов, способствующих растворению – окисление-восстановление, образование малодиссоциирующих соединений и др.
Например, HgS не растворим в кислотах, но хорошо растворяется в смеси KI + HCl;
HgS↓ + 4KI + 2HCl ó K2[HgI4] + H2S + 2KCl
6. Превращение одних малорастворимых соединений в другие.
При осаждении сульфатов катионов 3й аналитической группы возникают трудности с растворением осадка, т.к. сульфат бария не растворим в кислотах. Для решения этой проблемы сульфаты бария, стронция и кальция вначале переводят в карбонаты обработкой насыщенным раствором карбоната натрия:
BaSO4↓ + CO32– ó BaCO3↓ + SO42–
Карбонаты легко растворяются в кислотах. Константа равновесия этой реакции
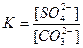
Домножим и разделим это выражение на одну и ту же величину – равновесную концентрацию ионов бария
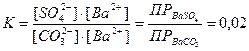
Из значения константы равновесия следует, что обработку карбонатом натрия следует проводить несколько раз при кипячении, удаляя каждый раз надосадочную жидкость. Это позволит сдвинуть равновесие реакции вправо.
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн.1.– С. 158-188.
2. Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч.1. – С. 109-124.
3. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн.1. – С. 84-101.
4. Основы аналитической химии. В 2-х книгах / Под ред. Ю.А.Золотова. – М.: Высш.шк., 2004. – Кн.1. – С. 188-204.
5. Васильев В.П. Аналитическая химия. В 2-х книгах. – М.: Дрофа, 2002. – Кн.1. – С. 252-274.
6. Алексеев В.Н. Курс качественного химического полумикроанализа. – М.:Химия, 1973. – С. 148-184.
Дата добавления: 2017-03-12; просмотров: 4653;










