Растворение как физико-химический процесс
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).
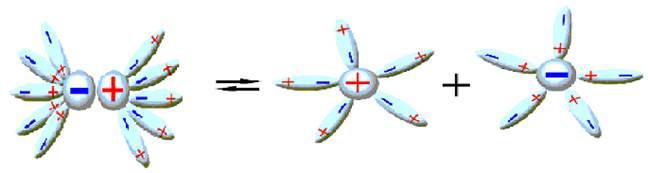

Рис.1 Процесс растворения электролитов.
Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо - и экзотермических стадий процесса. Наиболее значительными среди них являются:
– поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
– выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH- выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры).
Взаимная растворимость жидкостей или твердых веществ в жидкостях зависит от ряда свойств этих веществ: химической природы, величины и строения частиц, электрического заряда (в случае ионов), дипольных моментов и т. д.
Известна так называемая неограниченная растворимость, когда две жидкости растворяются одна в другой во всех соотношениях, и ограниченная, когда растворимость одной жидкости в другой ограничена определенной концентрацией.
При ограниченной взаимной растворимости двух жидкостей А и Б каждая из них растворяется, причем после отстаивания образуется два слоя, которые располагаются один над другим в порядке уменьшения плотности и состоят один из раствора Б в А, а другой -- из раствора А в Б.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью своего состава, а от вторых - своей однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами.
Д.И. Менделеев впервые стал рассматривать растворение не только как физический процесс, но и как процесс химического взаимодействия растворяемого вещества с растворителем. В частности, при растворении всегда поглощается или выделяется энергия (теплота растворения) и изменяется объем жидкости.
Исследование растворов с помощью разных методов дало возможность установить наличие во многих из них так называемых сольватов или гидратов, которые образуются в результате соответствующих процессов сольватации и гидратации.
Гидратация веществ в водных растворах составляет отдельный случай сольватации всяким растворителем. Если растворитель вода, то эти соединения называются гидратами. Процесс гидратации следует рассматривать как химическую реакцию присоединения воды к веществу. Гидратация происходит под влиянием сил молекулярного взаимодействия молекул воды и гидратированного вещества. Соли гидратируются ионами, имеющими значительные электрические поля, которые притягивают электрические полярные молекулы воды. Чем сильнее поле иона, то есть чем больший его заряд и меньший радиус, тем сильнее он гидратируется и тем крепче образованные гидраты. Образование сольватов во многих случаях изменяет свойства растворяемого вещества, что легко определяется непосредственным наблюдением.
Например, йод, который состоит из отдельных молекул, в газообразном состоянии имеет фиолетовое окрашивание. Такое же окрашивание сохраняется при растворении йода в бензине. Если же йод растворить в спирте, получается раствор темно-коричневого цвета. Эта смена окраски свидетельствует о наличии взаимодействия между молекулами йода и спирта.
Гидраты - довольно неустойчивые соединения, во многих случаях разлагаются уже при выпаривании растворов. Но иногда гидратная вода настолько прочно связана с молекулами растворенного вещества, что при выделении последнего из раствора она входит в состав его кристаллов. К таким лекарственным веществам относятся глюкоза, терпингидрат, магния сульфат, меди сульфат, квасцы, кодеин и др., которые являются кристаллогидратами с различным содержанием кристаллизационной воды. При удалении воды из кристаллогидратов они изменяют внешний вид и отдельные свойства (меди сульфат, гипс, кристаллическая сода и др.).
В гидратированном состоянии пребывают и отдельные ионы растворенной в воде соли, что имеет определяющее значение для многих свойств растворов солей. Идея гидратации ионов в растворах была впервые высказана И.А. Каблуковым и В.А. Кистяковским.
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. Относительно растворимости в некоторой степени руководствуются старым положением «подобное растворяется в подобном» (similia similibus solventur), то есть в свете современных взглядов на строение молекулы это представляется так: в неполярных растворителях (бензин, эфир и др.) хорошо растворяются разные соединения с неполярными или малополярными молекулами и не растворяются вещества другого типа. Наоборот, растворитель с сильно выраженным полярным характером молекул (вода), как правило, растворяет вещества с молекулами полярного и отчасти ионного типов и не растворяет вещества с неполярными молекулами. К полярным растворителям относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент, с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Наличие полярных групп в молекуле вещества сильно влияет на его растворимость.
Как правило, вещества хорошо растворимы в воде и друг в друге, если на каждую полярную группу приходится не более трех атомов углеводородного радикала. При большем наличии углеводородных радикалов между молекулами возникают столь большие дисперсионные силы, что они препятствуют растворению таких веществ в полярных растворителях.
Полярные вещества - это вещества с ионной (ионные кристаллы) и полярной связью (полярные молекулы), например, натрия хлорид.
К неполярным растворителям относятся жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например, углеводороды, галоидалкилы и др. Неполярные вещества - это вещества строго симметричной структуры, без электрических полюсов (например, парафин, скипидар, камфора, тимол и др.).
Однако вышеприведенное правило не всегда действительно, особенно в применении к сложным органическим соединениям, которые содержат как полярные (-ОН, -SO3H, -NH2, -COOH, -COONa), так и неполярные (алкильные или арильные радикалы) группы. К таким соединениям относятся углеводы, спирты, кетоны, органические кислоты, амины и др. Растворимость этих веществ зависит от преобладания полярных или неполярных групп. Например, спирт этиловый С2Н5ОН смешивается с водой в любых соотношениях, амиловый С5Н11ОН - не выше 10 %, а спирт цетиловый С16Н33ОН практически в воде не растворяется
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
1)Природа растворяемого вещества.

Рис.2 Природа растворенного вещества.
Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н - нерастворимые (менее 0,1 г на 100 г воды).
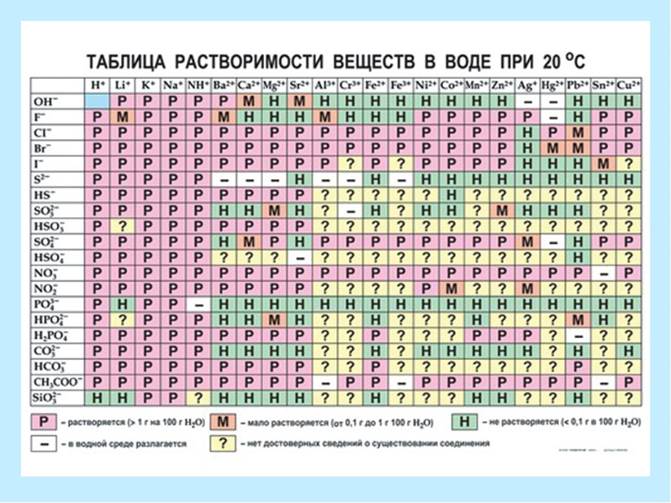
Рис.3. Таблица растворимости.
2) Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а
молекулярные вещества - наоборот.
Вода - уникальный, наиболее распространенный и доступный растворитель. Водные растворы неорганических (соли, кислоты, основания) и органических (аминокислоты, азотистые основания, нуклеиновые кислоты) веществ, низко – и высокомолекулярных соединений, электролитов и неэлектролитов, составляют основу важнейших биологических жидкостей, в которых протекают все физико – химические процессы, обеспечивающие жизнедеятельность организма. Например, в медицине используют искусственные аналоги биологических жидкостей – коллоидные и солевые кровезаменяющие растворы.

Рис. 4. Зависимость растворимости веществ от природы растворимости.
3)Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например, Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании. Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
4) Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Растворы веществ с молярной массой меньше 5000 г/моль называются растворами низкомолекулярных соединений (НМС), а растворы веществ с молярной массой больше 5000 г/моль – растворами высокомолекулярных соединений (ВМС).
По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на два класса – растворы электролитов и неэлектролитов.
Таблица 1.
Таблица электролитов и неэлектролитов.
| ЭЛЕКТРОЛИТЫ | НЕЭЛЕКТРОЛИТЫ (α =0) | |
| СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ (α ≈1) | СЛАБЫЕ ЭЛЕКТРОЛИТЫ (α<<1) | Оксиды, не взаимодействующие с водой. Простые вещества. Органические соединения кроме карбоновых кислот. |
| Растворимые соли (в том числе соли органических кислот) | Некоторые малорастворимые и нерастворимые соли | |
| Сильные кислоты (HC1, HI и др.) | Слабые кислоты, в том числе органические (HCOOH, CH3COOH и др.) | |
| Сильные основания – щелочи (NaOH, KOH и др.) | Нерастворимые основания и NH4OH |
Растворы электролитов – растворы диссоциирующих на ионы солей, кислот, оснований, амфолитов. Например, растворы KNО3, HCl, КОН, Аl(ОН)3, глицина. Электрическая проводимость растворов электролитов выше, чем растворителя.
Растворы неэлектролитов – растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электрическая проводимость растворов неэлектролитов мало отличается от растворителя.
Растворы НМС (электролитов и неэлектролитов) называются истинными в отличие от коллоидных растворов. Истинные растворы характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Размер растворенных частиц (ионов и молекул) меньше 10-9 м.
Большинство ВМС – полимеры, молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок или мономерных звеньев, соединенных между собой химическими связями. Растворы ВМС называются растворами полиэлектролитов.
К полиэлектролитам относятся поликислоты (гепарин, полиадениловая кислота, полиаспарагиновая кислота и др.), полиоснования (полилизин), полиамфолиты (белки, нуклеиновые кислоты).
Свойства растворов ВМС существенно отличаются от свойств растворов НМС.
Дата добавления: 2016-05-28; просмотров: 6749;











