Изменения агрегатных состояний вещества
Слово агрегатный произошло от латинского слова aggrego (связываю, соединяю). Рассматривать основные агрегатные состояния веществ удобно на примере воды, которая в наших естественных земных диапазонах температур может находиться в трех состояниях (рис. 1): жидком (вода), твердом (лед или снег), газообразном (пар).



Рисунок. 1. Агрегатные состояния воды: лед, вода, пар
Отличия между агрегатными состояниями воды состоят в том, что частицы (молекулы) по-разному расположены друг относительно друга: на различных расстояниях и взаимодействуют по-разному. Кроме того, они еще с различной активностью двигаются: или свободно перемещаются, или частично связаны, или находятся в строго определенных положениях и колеблются относительно них.
1. Переходы между агрегатными состояниями
Важно знать и понимать, каким образом осуществляются переходы между агрегатными состояниями веществ. Схему таких переходов изобразим на рисунке 2.
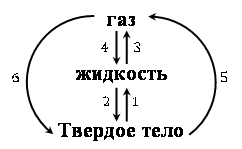
Рисунок. 2.
1 – плавление;
2 – отвердевание (кристаллизация);
3 – парообразование: испарение или кипение;
4 – конденсация;
5 – сублимация (возгонка) – переход из твердого состояния в газообразное, минуя жидкое;
6 – десублимация – переход из газообразного состояния в твердое, минуя жидкое.
2. Плавление и отвердевание
Плавление – процесс перехода из твердого состояния в жидкое. Этот процесс происходит при постоянной температуре.
Температура, при которой происходит плавление вещества, называется температурой плавления и является измеренной величиной для многих твердых веществ, а потому табличной величиной. Например, температура плавления льда равна 0oC, а температура плавления золота 1100oC.
Обратный плавлению процесс – процесс кристаллизации.
Если описанные процессы рассматривать с точки зрения внутренней энергии тела, то при плавлении вся полученная телом энергия расходуется на разрушение кристаллической решетки и ослабление межмолекулярных связей, таким образом, энергия расходуется не на изменение температуры, а на изменение структуры вещества и взаимодействия его частиц. В процессе же кристаллизации обмен энергиями происходит в обратном направлении: тело отдает тепло окружающей среде, а его внутренняя энергия уменьшается, что приводит к уменьшению подвижности частиц, увеличению взаимодействия между ними и отвердеванию тела.
График плавления и кристаллизации
Полезно уметь графически изобразить процессы плавления и кристаллизации вещества на графике (рис. 3).
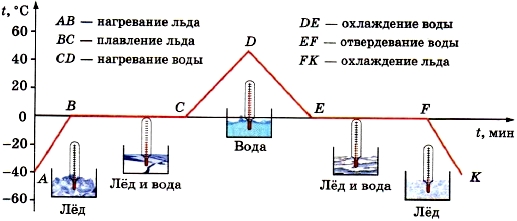
Рисунок.3.График плавления и кристаллизации льда
Удельная теплота плавления– количество теплоты, которое необходимо сообщить 1 кг вещества, нагретому до температуры плавления, чтобы перевести его из твёрдого состояния в жидкое.
Такая же величина выделяется и при кристаллизации 1 кг вещества.
Обозначается удельная теплота плавления 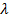 (греческая буква, читается как «лямбда» или «ламбда»).
(греческая буква, читается как «лямбда» или «ламбда»).
Единицы измерения:
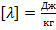 .
.
В данном случае в размерности отсутствует температура, так как при плавлении (кристаллизации) температура не меняется.
Дата добавления: 2017-03-12; просмотров: 3643;











